Kim's Weekly 12월 5주차 의약품 품목허가·임상승인 현황
거대세포종, 위식도역류질환 신약 품목허가
비소세포폐암, 제2형 당뇨병 임상시험 집중

한국다이이찌산쿄가 거대세포종 치료제 '투랄리오캡슐200밀리그램'을, 대웅제약은 P-CAB제제 펙수프라잔염산염 성분 미란성 역류질환 치료제 '펙수클루정40밀리그램'을 각각 신약으로 허가받았다.
지난주((2021.12.26~2022.01.01) 식품의약품안전처는 의약품 39품목(전문약: 30개, 일반약: 9개), 임상시험 36건(1상: 30개, 2상: 4개, 3상: 7개, 연구자: 5개)을 각각 승인했다.
거대세포종, 위식도역류질환 신약 품목허가
허가사항에 따르면 한국다이이찌산쿄의 투랄리오캡슐200밀리그램(펙시다티닙염산염)은 증상을 동반하고 수술로는 개선이 어려운, 중증 이환 상태이거나 기능적 제한이 있는 건활막 거대세포종(Tenosynovial Giant Cell Tumor, TGCT)을 가지고 있는 성인 환자의 치료에 사용된다.
간독성 위험으로 인해 위해성 관리계획에 따른 제한적 프로그램을 통해서만 사용 가능하며 특수한 상황에서는 주 1회 간기능 검사 모니터링이 필요하다.
대웅제약의 펙수클루정40밀리그램(펙수프라잔염산염)은 미란석 위식도역류질환 치료제로 위벽에서 위산을 분비하는 양성자 펌프를 차단하는 P-CAP(Potassium-Competitive Acid Blocker)제제로, 국내 P-CAP제제 중 대표 품목은 2021년 1000억원 매출이 예상(11원 누적 984억원)되고있는 HK이노엔의 '케이캡정'이다.
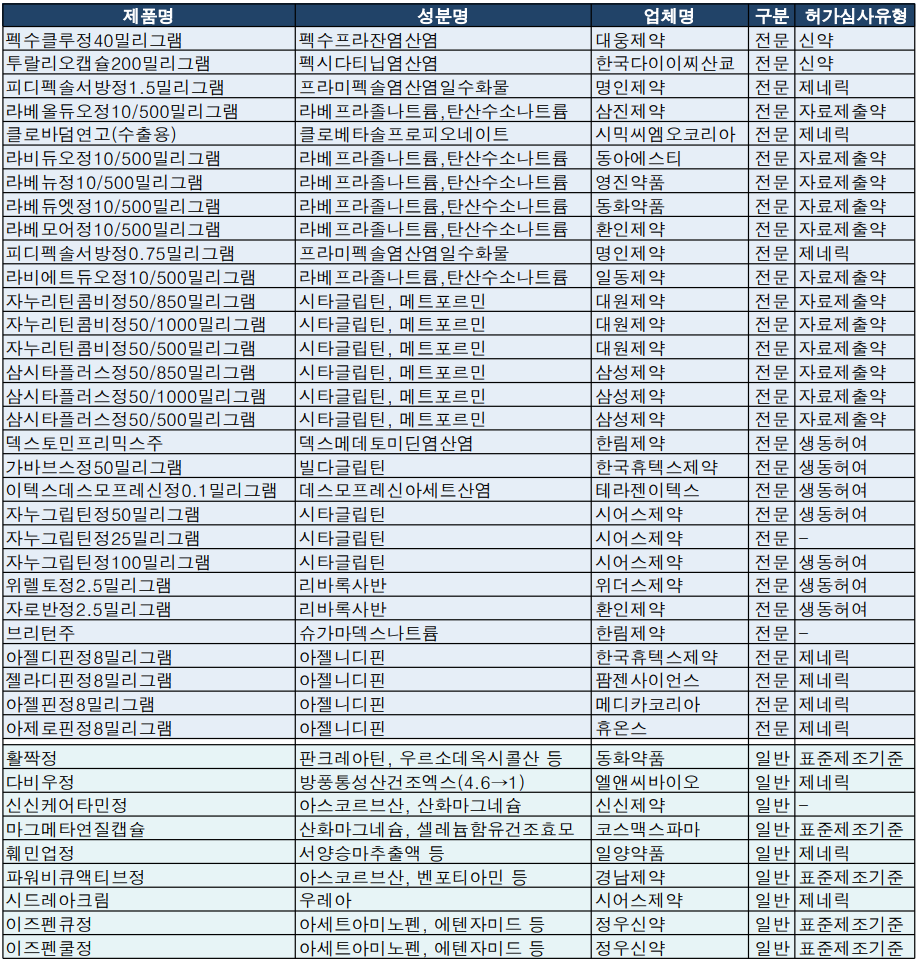
이밖에 지난주 식약처 품목허가 목록에는 라베프라졸나트륨/탄산수소나트륨 복합성분 위궤양, 십이지장궤양 등 치료제와 시타글립틴/메트포르민 복합제인 제2형 당뇨병 치료제가 대거 이름을 올렸다.
삼진제약, 동아에스티, 영진약품, 동화약품, 환인제약은 '라베올듀오정10/500밀리그램', '라비듀오정10/500밀리그램', '라베뉴정10/500밀리그램', '라베듀엣정10/500밀리그램', '라베모어정10/500밀리그램'을 각각 허가받았다.
대원제약과 삼성제약은 '자누리틴콤비정', '삼시타플러스정' 1000/50, 850/50, 500/50밀리그램 등 총 6개 품목 허가를 획득했다.
비소세포폐암, 제2형 당뇨병 임상시험 집중
2021년 마지막 임상시험 승인 목록에는 아스트라제네카 제2형 당뇨병치료제 '직듀오서방정' 생물학정동등성 평가와 비소세포폐암 관련 임상시험 3상이 다수 확인됐다.
메디카코리아와 대한뉴팜은 직듀오 서방정 생동성 시험에 나설 예정이다.
베이진코리아는 이전에 치료받지 않은 국소 진행성, 절제 불가능 비소세포폐암에서 오시페르리맙(BGB-A1217) + 티스렐리주맙(BGB-A317) + 동시 화학방사선요법(cCRT) 후 오시페르리맙 + 티스렐리주맙 또는 티스렐리주맙 + cCRT 후 티스렐리주맙 대 cCRT 후 더발루맙 비교평가에 나선다. 국내 대상 환자는 72명(글로벌 900명)이며 가톨릭대 성빈센트병원, 부천성모병원, 고대 구로병원 등이 실시기관으로 참여한다.
한국아스트라제네카는 근치적인 백금 기반 동시적 화학방사선요법 치료 후 질병이 진행하지 않은, 절제 불가능한 국소 진행성(III기) 비소세포폐암(NSCLC) 환자 65명(글로벌 999명)을 대상으로 Durvalumab+Oleclumab과 Durvalumab+Monalizumab의 안전성 유효성 평가에 나선다. 서울대학교병원이 실시기관이다.
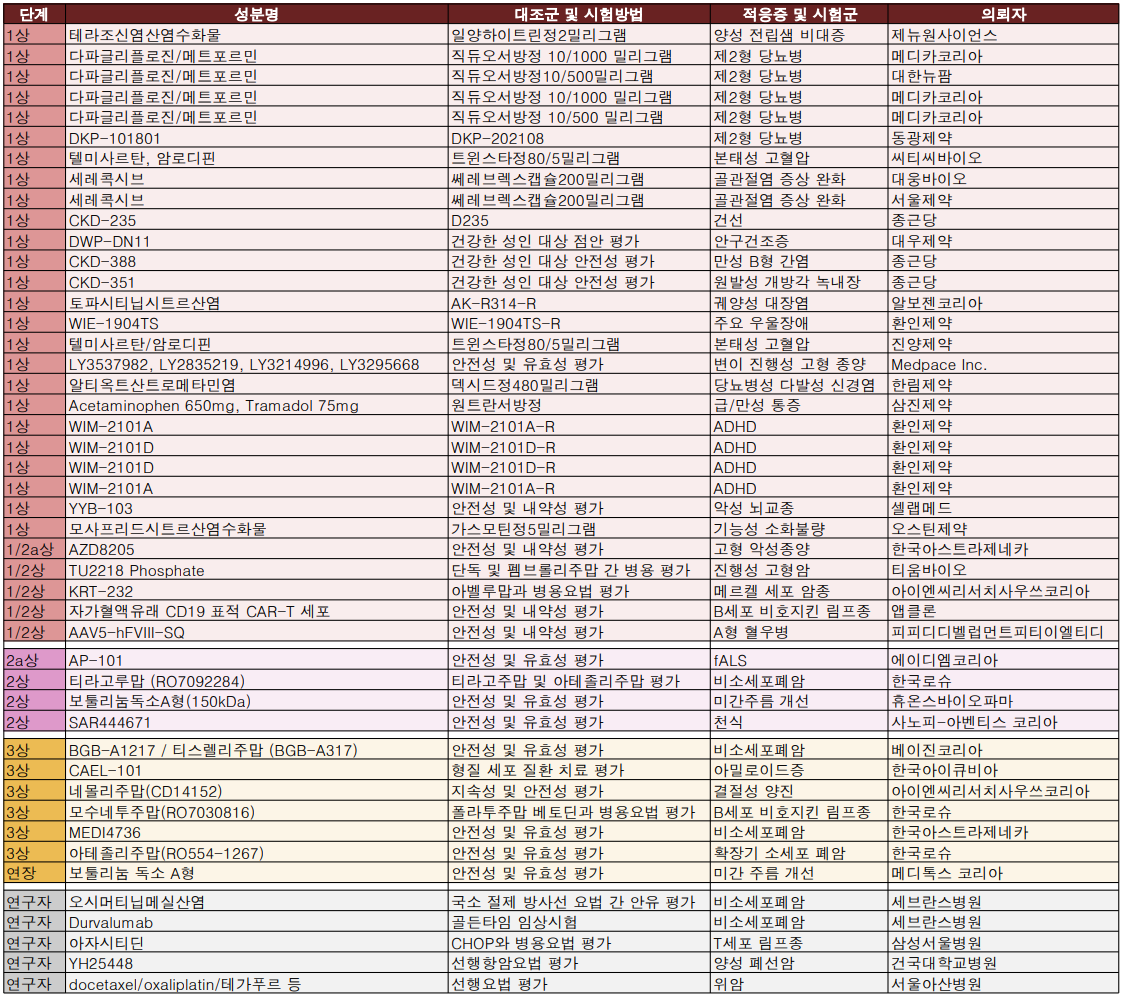
연세대학교 의과대학 세브란스병원은 비소세포폐암에 대한 2건의 연구자 임상시험을 각각 승인받았다.
수술가능한 비소세포폐암(NSCLC)의 면역 동력학을 밝히기 위한 durvalumab (MEDI4736)의 골든 타임 임상시험과, 동시성 소수 전이 EGFR 돌연변이 비소세포폐암이 있는 환자를 대상으로 일차 요법 오시머티닙과 국소 절제 방사선요법의 안전성 및 유효성을 평가하는 임상시험으로 임핀지와 오시머티닙이 대상 의약품이다.
이밖에 환인제약은 주의력결핍과잉행동장애(ADHD) 치료제 개발을 위한 4건의 임상시험과 주울장애 치료제 1건 등 총 5건의 정신질환 치료제 임상시험에 나선다.

