Kim's Weekly 11월 4주차 의약품 품목허가·임상승인 현황
식약처, 비소세포페암 신약 2종 품목허가
한국노바티스 경구용 백혈병 치료제 임상 3상 승인

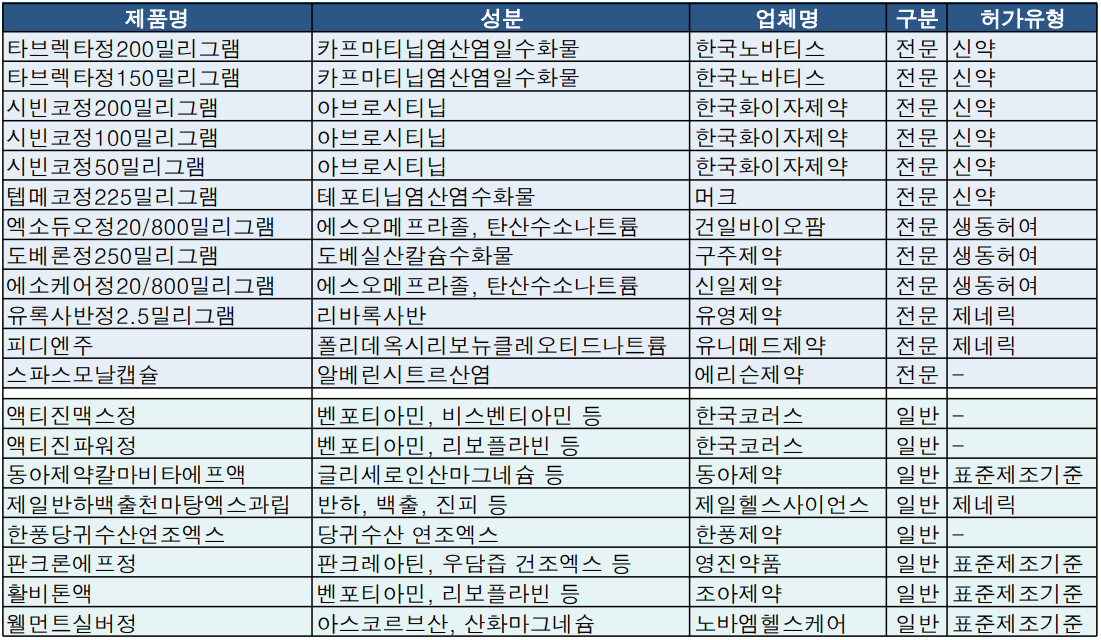
한국노바티스와 머크의 비소세포폐암신약인 MET 억제제 '타브렉타정', '텝메코정'이 각각 신약으로 식품의약품안전처 전문의약품 품목허가를 획득했다.
한국화이자제약의 중증아토피피부염치료제 '시빈코정'도 신약으로 품목허가를 획득했다.
지난 주(2021.11.22~2021.11.28) 식약처는 의약품 20품목(전문약: 12개, 일반약: 8개), 임상시험 25(1상: 16개, 2상: 3개, 3상: 5개, 연구자: 1개)건을 각각 승인했다.
식약처, 비소세포페암 신약 2종 품목허가
타브렉타와 텝메코는 모두 MET 엑손 14 결손(Skipping)이 확인된 국소 진행성 또는 전이성 비소세포폐암치료제다. MET는 염색체 7번 장완에 위치한 원종양유전자로, MET 경로에 조절 장애가 생기면 종양 세포의 증식과 전이를 촉진할 수 있다.
타브렉타는 MET 수용체 티로신 키나아제를 선택적으로 억제하는 기전의 약물로 지난해 5월 FDA허가를 획득했다. 미국(Drugs.com) 기준 한 달 처방비용(비급여)은 9894달러(1174만원)다. 같은 기전 약물인 텝메코는 올해 2월 FDA 승인을 받았으며 처방비용은 2만1827달러(2590만원)로 확인되고있다.
한국화이자제약은 아토피 피부염 치료제 '시빈코정' 3개 용량(50/100/200mg) 품목허가를 획득했다. 식약처 허가사항에 따르면 시빈코정은 성인 및 만 12세 이상 청소년의 중등증에서 중증 아토피 피부염 치료에 사용한다.
건일바이오팜과 신일제약은 종근당 위식도 역류질환 치료제 '에소듀오'제네릭인 '엑소듀오정20/800밀리그램(에스오메프라졸, 탄산수소나트륨)', '에소케어정20/800밀리그램'을 각각 허가받았다. 두 품목은 모듀 제뉴원사이언스가 위탁제조한다.
한국노바티스 경구용 백혈병 치료제 임상 3상 승인
4세대 백혈병 치료제로 알려진 한국노바티스의 경구용 치료제 후보물질 '아시미닙염산염'이 임상시험 3상 승인을 획득했다.
이번 임상시험은 새로 진단된 만성기의 필라델피아 염색체 양성 만성 골수성 백혈병 환자의 경구용 아시미닙과 시험자 선택의 TKI 간 비교평가로 삼성서울병원, 서울대학교병원 등에서 국내환자 20명(글로벌 402명)을 대상으로 진행된다.
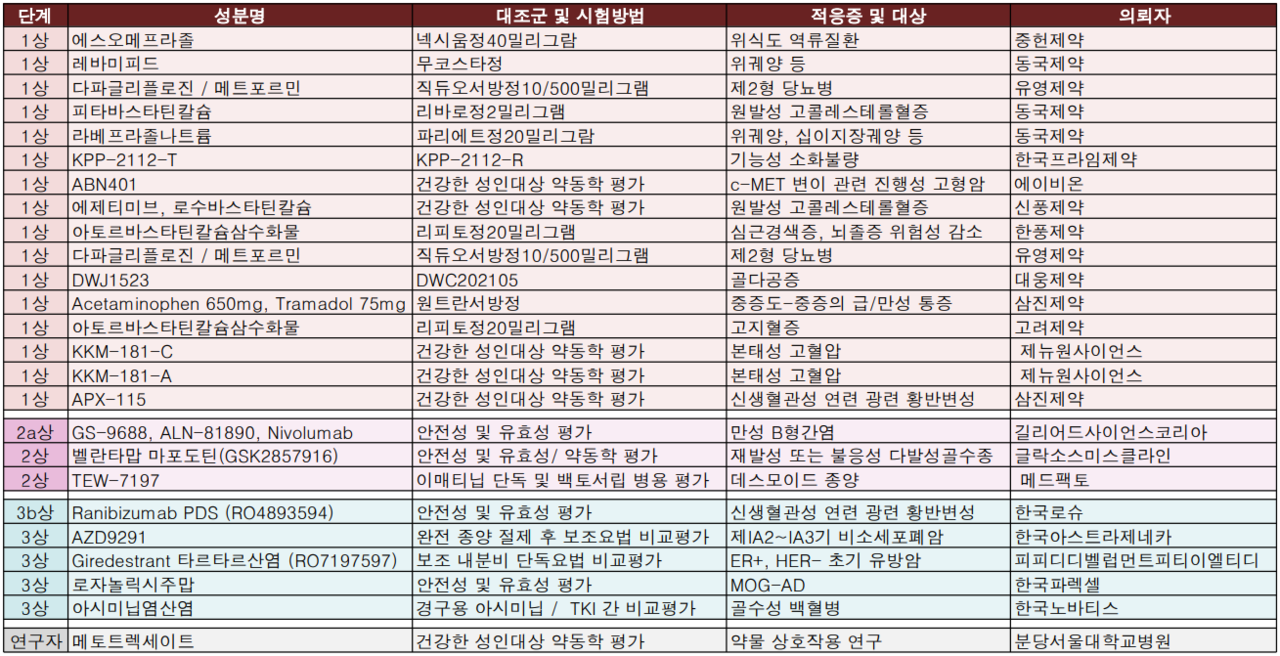
한국아스트라제네카는 비소세포폐암 치료제 '타그리소(오시머티닙, AZD9291)'의 임상시험 3상을 진행할 예정이다. 이번 임상시험은 표피성장인자수용체 돌연변이 양성 제IA2~IA3기 비소세포폐암환자의 완전 종양 절제 후 보조요법의 유효성 및 안전성을 평가한다.
글로벌 380명, 국내 18명 환자를 대상으로 진행되며 서울대학교병원, 충북대학교병원이 실시기관이다.
이밖에 유영제약은 직듀오서방정 제네릭인 다파글리플로진/메트포르민 복합제에 대한 공복/식후 임상 2건을 각각 승인받았다. 에이치플러스 양지병원이 진행한다.

