Kim's Weekly 11월 3주차 의약품 품목허가·임상승인 현황
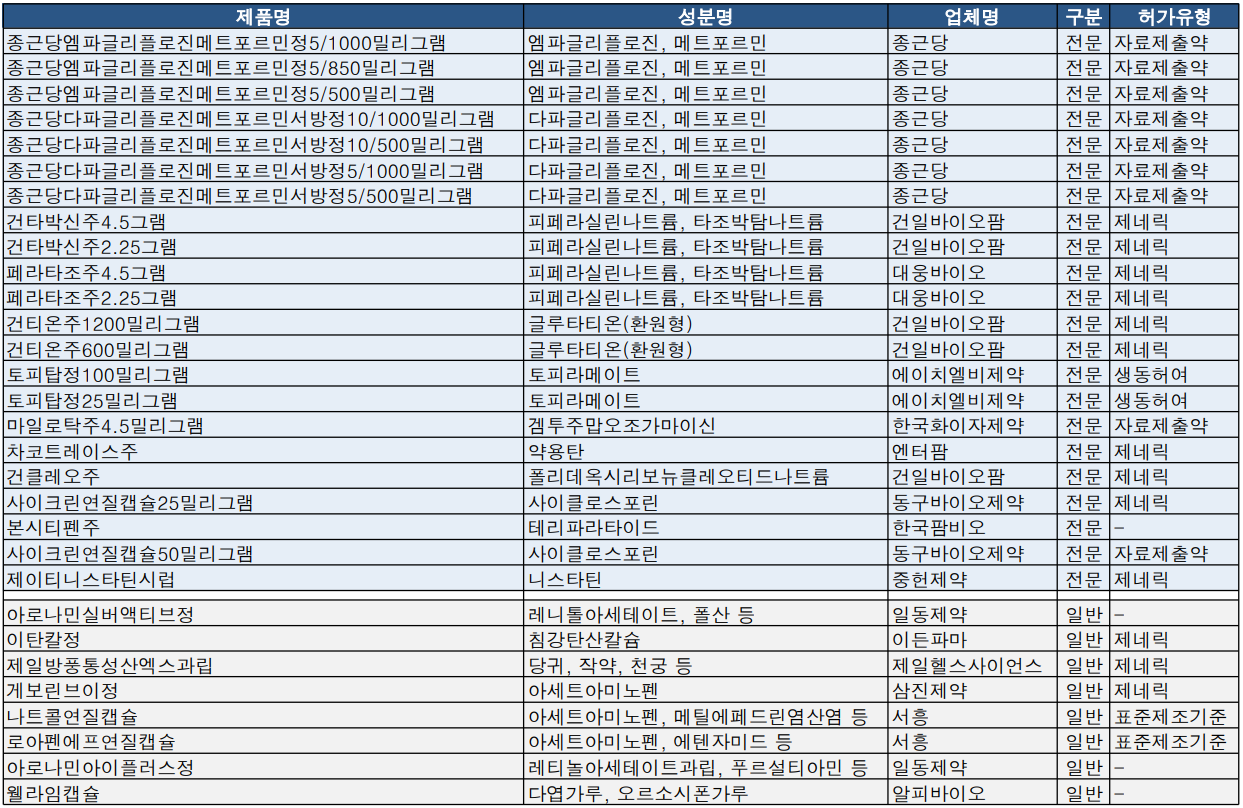
종근당 자디앙듀오정 제네릭 용량 확대
글라세움, 한국노보노디스크제약 비만 치료제 임상 2건 승인

자디앙듀오정(엠파글리플로진/메트포르민) 첫 제네릭 출시를 알린 종근당이 엠파글리플로진 5밀리그램 용량군 3개(메트포르민 1000/850/500mg) 품목허가를 추가로 획득 했다. 또한 직듀오서방정(다파글리플로진/메트포르민) 4개 용량군 품목허가를 승인 받았다.
한국화이자제약은 급성 골수성 백혈병 치료제 '마일로탁주 4.5밀리그램' 품목허가를 획득했다.
임상시험 승인 현황에는 과체중·비만치료제 2건이 이름을 올리면서 만성질환 치료제 시장 공략이 계속되는 양상을 보였다.
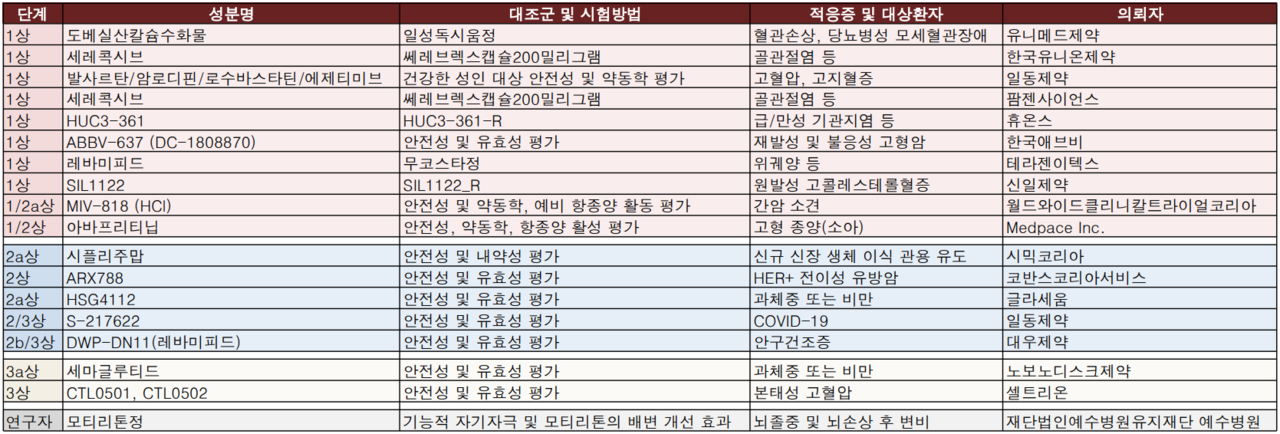
지난 주(2021.11.14~2021.11.21) 식품의약품안전처는 의약품 30품목(전문약: 22개, 일반약: 8개), 임상시험 18건(1상: 10개, 2상: 5개, 3상: 2개, 연구자: 1개)을 각각 승인했다.
우판권 이점 극대화, 종근당 자디앙듀오정 제네릭 용량 확대
△최초 특허심판 청구 △최초 허가신청 요건을 충족해 한국베링거잉겔하임의 제2형 당뇨병치료제 '자디앙듀오정' 우선판매품목허가(우판권)을 획득한 종근당은 지난주 3개 용량군 품목허가를 추가로 획득하며 당뇨병시장 치료제 용량군을 넓혔다.
또한 종근당은 직듀오서방정(다파글리플로진, 메트포르민) 제네릭 역시 4개 용량군(다파글리플로진/메트포르민: 10/100, 10/500, 5/1000, 5/500mg) 품목허가를 획득하기도 했다.
한국화이자제약은 앞서 희귀의약품으로 지정받았던 급성 골수성 백혈병 치료제 마일로탁주4.5mg 품목허가를 획득했다. 허가사항을 살펴보면 마일로탁주는 새롭게 진단된 CD33 양성 급성 골수성 백혈병 성인 환자 치료에 사용된다.
글라세움, 한국노보노디스크제약 비만 치료제 임상 2건 승인
글라세움과 노보노티스크제약은 과체중 및 비만 환자를 대상으로한 임상시험 2상, 3상을 각각 승인받았다.
글라세움은 국내환자 80명을 대상으로 HSG4112에 대한 12주 경구 투여 시험을 진행할 예정이다. 시험기관은 서울대학교병원, 고대부속병원으로 확인됐다.
노보노티스크제약의 임상시험 3상은 강북삼성병원이 진행한다. 국내 40명(동아시아 198명)을 대상으로 하는 이번 임상시험은 동아시아인을 시험대상자로 한 경구용 세마글루티드 50mg의 1일 1회 투여안전성, 유효성 평가가 진행될 예정이다.
일동제약이 일본 시오노기제약과 공동개발하는 경구용 코로나19 치료제 후보물질 'S-217622'임상시험(2/3상)도 진행될 예정이다. 전체환자 2019명, 국내 200명환자를 대상으로 진행되는 이번 임상시험은 인하대학교의과대학 부속병원이 진행한다.