식약처, 11월 1일 품목허가·DMF등록 신청부터 적용
완제·무균원료 우선시행...내년 비무균원료까지 확대

코로나19로 인한 해외제조소 사전 GMP 비대면실사가 시행된다.
당장 이달 1일 품목허가·신고·DMF등록 신청(변경포함)건부터 적용된다.
식품의약품안전처는 '해외제조소 사전 GMP 비대면실사 방안'을 업계에 안내했다.
평가방안에 따르면 이달 1일 완제와 무균원료에 대해 우선실시하고 내년 1월 1일부터 비무균원료까지 확대된다.
비대면실사 절차는 민원신청 → 실사일정 및 방식협의 → 실사일정통보 → 비대면실사(실시간 자료검토 및 영상회의) → 평가결과 통보로 진행된다.
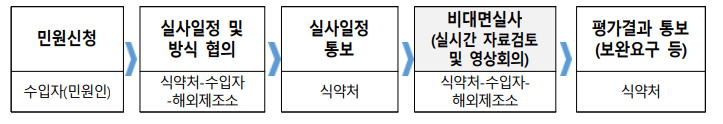
실시간 자료검토는 의약품안전관리시스템 실사지원프로그램을 활용하고, 영상회의에서는 질의응답, 동영상 및 실시간 현장확인, 지적사항 확인 등이 이뤄진다.
민원 신청 시 '의약품등 품목별 사전 GMP 평가 운영지침'의 제출자료(서류) 요건에 따른 자료를 준비해야 한다.
또한 ①해당 품목의 제조공정 현황을 확인할 수 있는 작업소 동영상 촬영본 ②해당 품목과 관련된 시험 실시 현황을 확인할 수 있는 시험실 동영상 촬영본 ③해당 품목의 원자재·반제품·완제품 보관 현황을 확인할 수 있는 보관소 동영상 촬영본 ④해당 품목과 관련된 제조지원설비(공기조화시스템, 제조용수시스템 등) 설치 현황을 확인할 수 있는 동영상 촬영본 ⑤무균조작 제제의 경우, 공정 모의시험(배지충전) 실시 현황을 확인할 수 있는 동영상 촬영본도 제출해야 한다.
관련기사
이현주 기자
hjlee@hitnews.co.kr
폭 넓은 취재력을 바탕으로 제약산업과 건강보험정책 사이 퍼즐찾기에 주력하고 있습니다.

