박병준 가신길TV PD의 2021 유럽종양학회 참관기
몸은 서울에 있지만, 마음만은 파리에
필자는 9월16일부터 21일까지 파리에서 열린 유럽종양학회에 참석했다. 직접 파리까지 간 것은 아니고 직접 등록하여 온라인으로 시청했다. 4월에 열렸던 미국암연구학회(AACR), 6월에 열렸던 미국임상종양학회(ASCO)는 100% 가상 회의로 진행된 반면, 이번 유럽종양학회는 하이브리드로 진행됐다. 소속이 유럽에 있는 발표자들은 대부분 현장에 참여했고 미국에 있는 분들도 상당수 참석했다.

이번 ESMO가 AACR, ASCO와 달랐던 점은 구두 발표자와 초청 토론자의 논의 후, 객석 질문을 받았다는 것이다. 더불어 채팅창을 통해서도 질문할 수 있었다. 채팅창에 있는 모든 질문에 답한 것은 아니고, 온라인 참석자의 투표를 통해 많은 지지를 받으면, 선별해 답했다. 필자도 여러 세션에서 20여개의 질문을 난사(?)했고 그 중 '2개'는 많은 분들의 지지를 받아 논의될 수 있었다.
다른 학회가 그렇듯, 유럽종양학회에도 △사전 녹화된 교육 세션 △특별 심포지엄 △글로벌 바이오 파마의 개별 세션으로 구성돼 있다. 특정 임상 연구에 기반한 구두 발표도 배움을 얻을 수 있는 귀한 기회지만, '교육 세션'을 통해 얻을 수 있는 것도 상당했다.
HER2 양성 유방암 2차 약물과 엔허투
다이이찌산쿄와 아스트라제네카가 개발 중인 T-Dxd(엔허투)의 DESTINY-Breast03 연구를 시작으로 필자가 경험한 2021 유럽종양학회의 여러 발표 중, 인상 깊었던 것을 위주로 정리해 보겠다.
DESTINY-Breast03은 HER2 양성 유방암 2차 표준 치료제인 T-DM1(캐싸일라)과 엔허투의 일대일 비교 연구다. 엔허투는 DESTINY-Breast01 연구의 유망한 데이터를 기반으로 미국을 비롯한 다수의 국가에서 HER2 양성 유방암 3차+ 치료제로 승인받았다.
이번 임상 연구는 HER2 양성 유방암 영역 내 엔허투의 적응증 확장과 함께 강력한 HER2 프랜차이즈를 보유하고 있는 로슈·제넨텍의 HER2 타깃 항체약물접합체(ADC) 캐싸일라와 비교 연구를 했다는 점에서 주목받았다(종양학 임상에서 동일 타깃·모달리티 약물과 1:1 비교 연구를 하는 것은 비교적 드문 일). DESTINY-Breast03 연구는 유럽 종양학회 'Presidential Symposium'에서 발표됐고 이후 초청 토론자의 발표(Shanu Modi, MSKCC)와 활발한 패널 토론이 있었다.
이번 연구는 HER2 양성 유방암 1차 치료로 허셉틴, 탁센 병용요법를 투여 받은 환자를 주 대상으로 했고 퍼제타(Pertuzumab)가 포함된 병용요법을 받은 환자도 약 60%였다. 1차 유효성 평가지표는 무진행생존기간(PFS, by BICR), 2차 유효성 평가지표는 객관적 반응률(ORR), 반응 지속 기간(DOR) 등이었다.
무진행생존기간 중앙값(median PFS, by BICR)은 독립맹검심사위원회(BICR, Blinded Independent Central Review)기준, 엔허투은 도달하지 않았고(not reached) 캐싸일라는 6.8개월이었다.
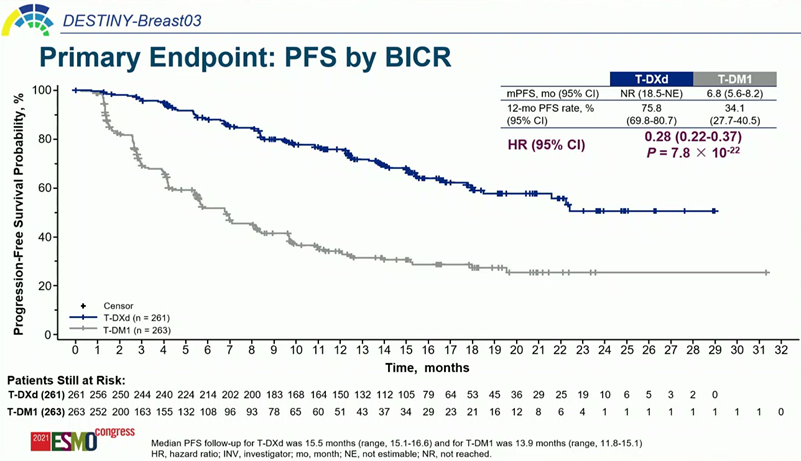
캐싸일라는 HER2 양성 유방암 2차 승인 근거였던 EMILIA 연구에서 무진행생존기간 중앙값 9.6개월를 도출했었다(Verma, S et al, N Engl J Med, 2012). 그러나 캐싸일라+티센트릭(항PD-L1항체) 병용요법 연구(Leisha A Emens et al, Lancet Oncol, 2020)에서 대조군 캐싸일라의 무진행생존기간 중앙값은 6.8개월이었고 여러 리얼월드데이터도 비슷했다. 비록 개별 임상 연구의 디자인은 조금 달랐지만, 캐싸일라의 무진행생존기간 중앙값은 비교적 일관성이 있었다.
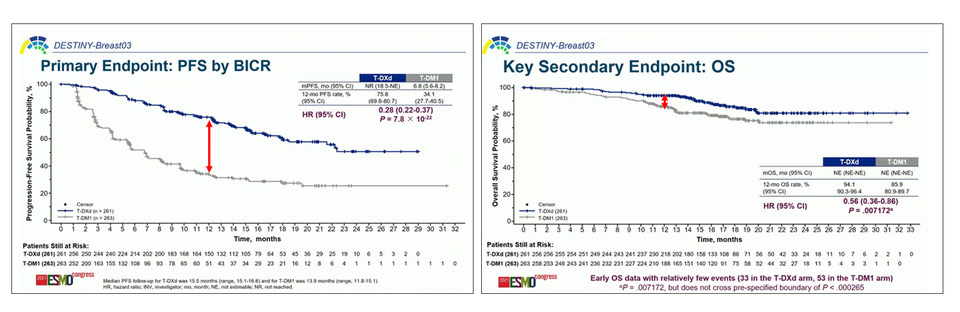
2차 유효성 평가지표는 전체생존기간 중앙값(median OS), 확인된 전체 반응률(cORR)을 살펴봐야 할 것이다. 초기 전체 생존기간 데이터는 상대적으로 적은 이벤트만 포함되었고(엔허투: 33 pts, 캐싸일라: 53 pts) 미성숙했지만, 생존 혜택을 엿볼 수 있는 추세는 있었다(HR: 0.56). 다만, 전체 생존기간의 카플란-마이어(Kaplan–Meier) 커브는 무진행생존기간처럼 의미 있는 간격(separation)을 보여주지 못했다.
엔허투의 안전성 프로파일에서 가장 주의 깊게 보는 것은 간질성 폐질환(ILD)이다. HER2 타깃 ADC에서 간질성 폐질환의 발병 원인이 타깃 때문인지, 링커-페이로드 때문인지는 불분명하지만, 간질성 폐질환 관련 모든 등급 발현 비율은 엔허투 10.5%, 캐싸일라 1.9%였다.

발표자(Javier Cortes)의 발표 후, 초청 토론자(Shanu Modi)의 토론이 있었다. 엔허투의 놀라운 효능에 대해서는 깊이 공감했지만, 캐싸일라 대비 높은 부작용에 대한 우려는 여전히 있었다. 하지만, 임상 경험이 축적돼 다양한 독성을 효과적으로 관리할 수 있다는 점은 긍정적으로 평가했다. 임상의들이 좀 더 관심 있는 주제는 엔허투 이후에 어떤 약물을 투여할 수 있냐는 것이었다.
2차 치료제로 엔허투를 투여한 후에 3차 이후에는 어떤 약물을 투여할 수 있을까? 엔허투가 2차 표준 치료제로 등극한다면, 타깃 혹은 페이로드에서 비롯되는 엔허투의 내성 요인을 해결할 수 있는 약물이 필요할 것이다.
예컨대, 지난 7월 칼럼에서도 소개했었던 비온디스(beyondis)의 HER2 타깃 ADC 'SYD985'의 임상 3상 발표 후에도 비슷한 문제 제기가 있었다. SYD985는 HER2 양성 유방암 3차+로 치료 대상을 설정했고 1차 유효성 평가지표는 만족했다(mPFS 7.0 vs 4.9, HR: 0.64).
해당 임상 연구에는 2차 캐싸일라 투여 경험자가 87.6%였다. 그렇다면, 2차 엔허투 투여 후 진행된 환자에게 SYD985를 투여했을 때, 효능과 안전성을 확보할 수 있을까? 작용기전 상, 엔허투의 페이로드(TOP1, topoisomerase I)와 SYD985(duocarmycin)의 페이로드는 다르기 때문에 효능이 있을 수도 있겠지만, 임상시험을 통해 명확한 근거를 확보해야 할 것이다.
이렇듯 기존 치료 라인에 '게임 체인저'가 등장하면 기존 약물들의 입지에는 상당한 변화가 올 수 있다. 패널 토론에서는 '효능이 좋고 관리 가능한 안전성 프로파일'이 있다면 가급적 빠른 시점에 투여하는 것이 환자들에게 유익할 것이라는 논의가 많았다.
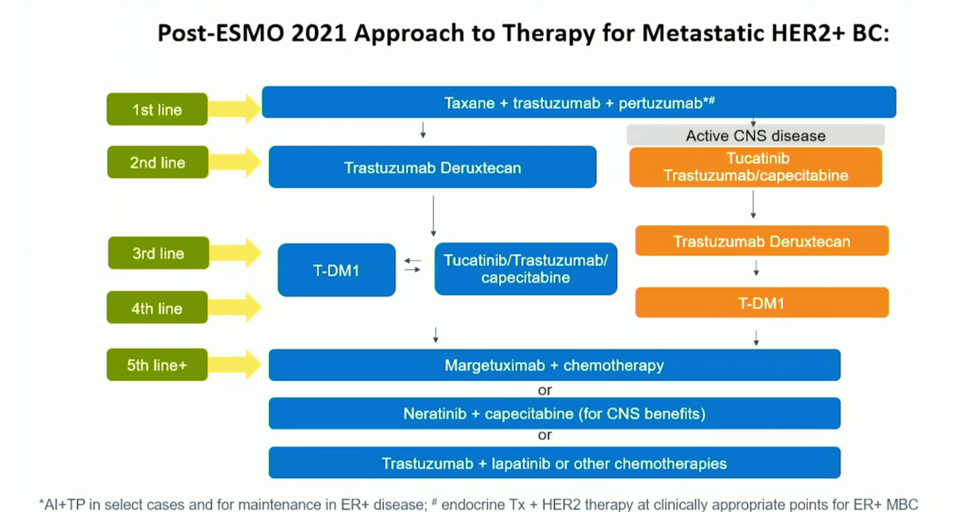
HER2 프랜차이즈의 맹주인 로슈·제넨텍은 이 영역을 사수하기 위한 행보가 없다. 지금까지는 HER2 양성 유방암 1차에서 허셉틴+퍼제타+탁센 병용요법이 표준 치료제로 자리 잡고 있지만, 최근 엔허투는 이들 병용요법 조합과 일대일 비교 연구를 시작했다(DESTINY-Breast09). 몇 년 후, DESTINY-Breast09 연구 결과가 긍정적으로 나온다면, 지금보다 훨씬 큰 변화가 있을 것이다.
실행 가능한 게놈 변경(Actionable Genomic Alteration)과
항체 약물 접합체 (1)
실행 가능한 게놈 변경이 있다면, 그에 따른 표적 치료를 할 수 있겠지만, 비소세포폐암에는 HER2 타깃 표적 치료제가 없다. 따라서 이러한 돌연변이가 있는 환자들은 백금계 화학 항암제와 항PD-(L)1항체에 의존할 수밖에 없다(미충족 의료 수요 존재).
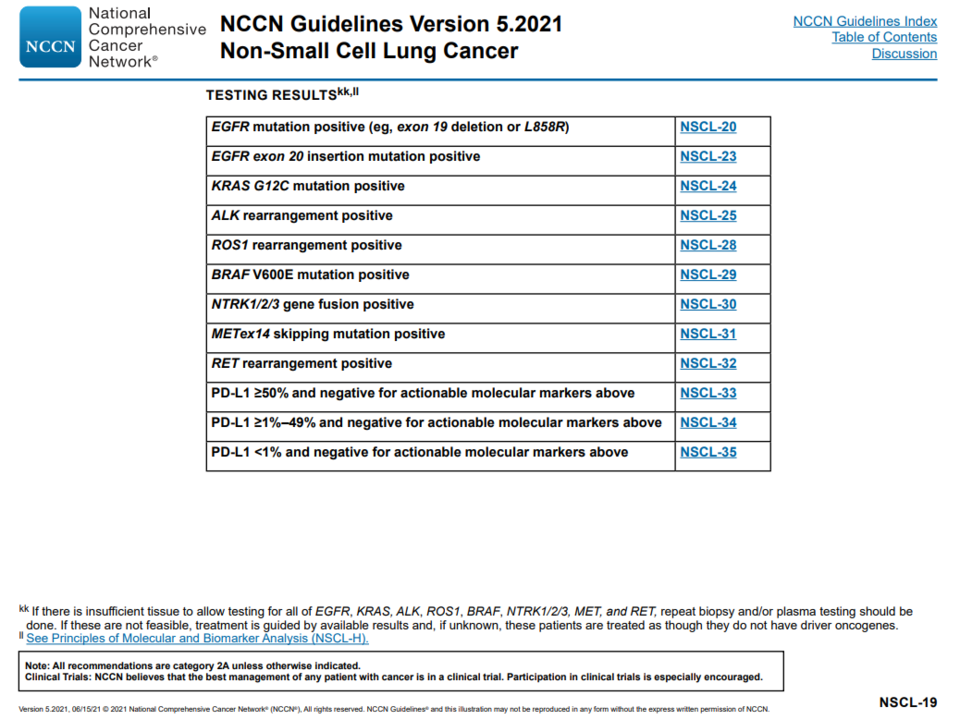
이번 유럽 종양학회에서 발표된 엔허투 관련 연구 중, HER2 돌연변이가 있는 비소세포폐암 환자 대상 DESTINY-Lung01 연구도 흥미로웠다.
현재 비소세포폐암에서 승인된 약물 중, HER2 타깃 약물은 없다. 한미약품이 개발해 스펙트럼(Spectrum)에게 라이센싱한 포지오티닙(Poziotinib)이 HER2 엑손20 삽입이 있는 비소세포폐암 환자 대상 임상시험을 진행하고 있다. 이전 치료 경험이 있는 환자(ZENITH20, 코호트 2)에서 유망한 데이터를 발표한 바 있고 이번 유럽종양학회에서는 치료 경험이 없는 환자(ZENITH20, 코호트 4) 대상 데이터를 발표했다.
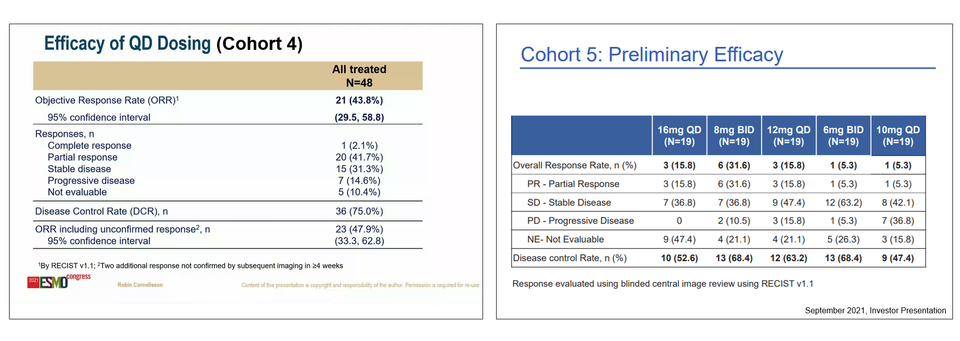
DESTINY-Lung1 연구에는 두 개의 코호트가 있는데 코호트 1은 HER2 과발현 환자 대상, 코호트 2는 HER2 돌연변이 환자 대상이다. 이번에 발표된 데이터는 표준 치료 후 재발/불응한 HER2 돌연변이 환자 대상 데이터이다. 모집 환자의 대부분은 카이네이즈 도메인(kinase domain)에 돌연변이가 있었고(93.4%) 이전에 백금계 화학 항암제, 항PD-(L)1항체를 투여 받았다. 엔허투의 확인된 전체 반응률(ORR)은 완전 반응(CR) 1명을 포함하여 53.8%였고(50/90) 반응 지속 기간(DOR)은 9.3 개월이었다.
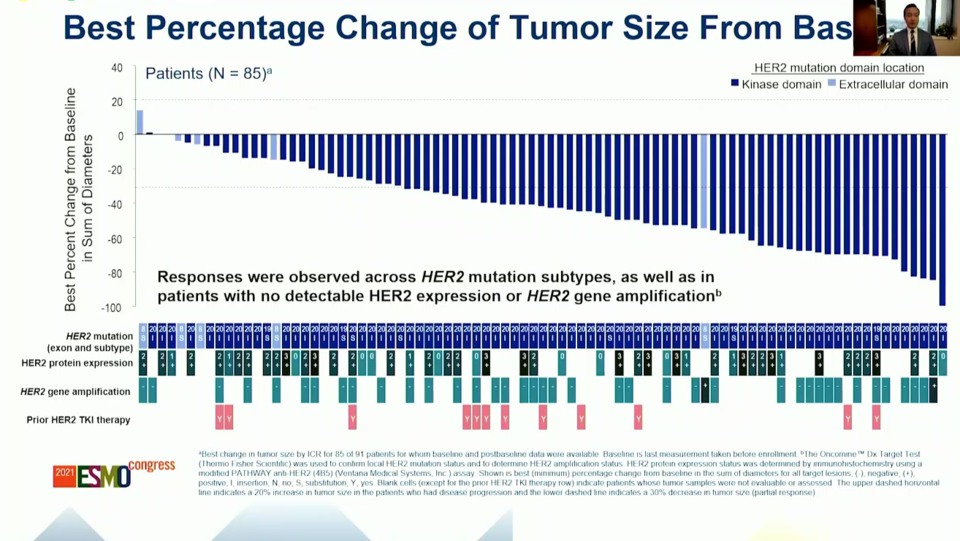
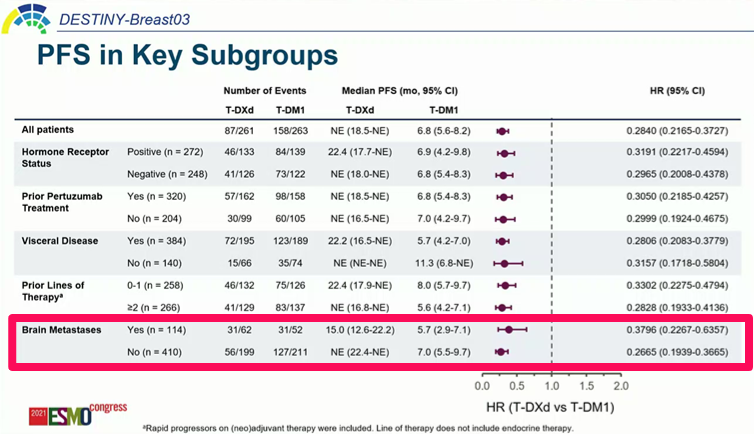
더불어 하위 그룹의 반응률도 흥미로웠는데 기준선에서 뇌 전이 유무와 상관없이 고른 반응률을 보였고(54.5% vs 55.2%) 이전에 백금계 화학 항암제만 경험한 환자와 백금 화학 항암제+항PD-(L)1 항체 경험자 간에도 유의한 차이가 없었다(53.5% vs 64.9%).
부작용은 전반적으로 양호했지만, 간질성 폐질환 관련 5등급 환자가 2명 발생했다. 발표자 설명에 따르면, 모든 약물 관련 간질성 폐질환 환자가 관리 가이드라인에 따라 글루코코르티코이드를 투여 받은 것은 아니라고 했다. 5등급 환자의 글루코코르티코이드를 투여 여부는 불명확하다.
실행 가능한 게놈 변경(Actionable Genomic Alteration)과
항체 약물 접합체 (2)
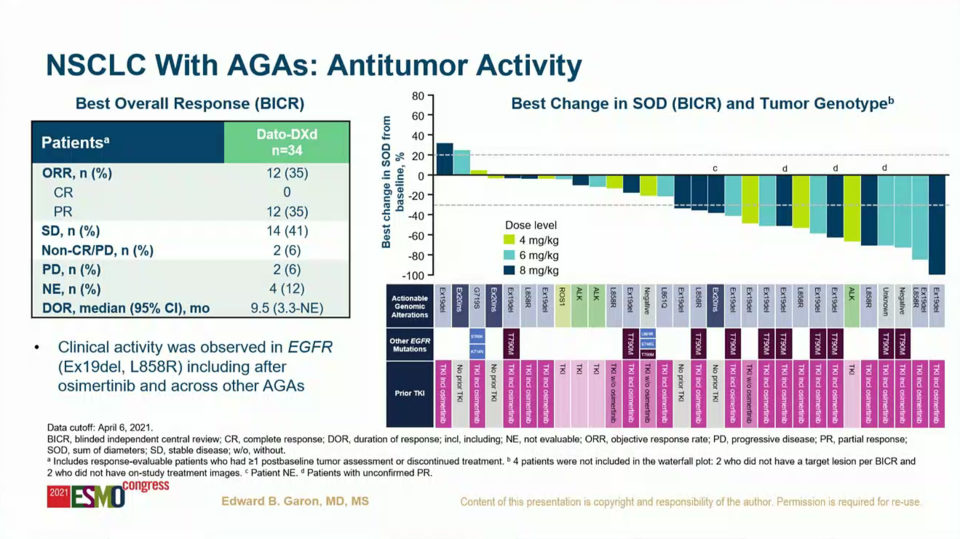
다이이찌산쿄/아스트라제네카의 항TROP2 ADC(datopotamab deruxtecan)도 데이터 업데이트가 있었다. 다포포타맙 데룩스테칸의 비소세포폐암 임상 전략은 ‘실행 가능한 게놈 변경이 없는’ 환자에 좀 더 방점이 있다. 지난 ASCO에서 발표한 재발/불응 비소세포폐암 임상(TROPION-PanTumor01 연구)에서는 약 25%의 ORR를 도출한 바 있다.
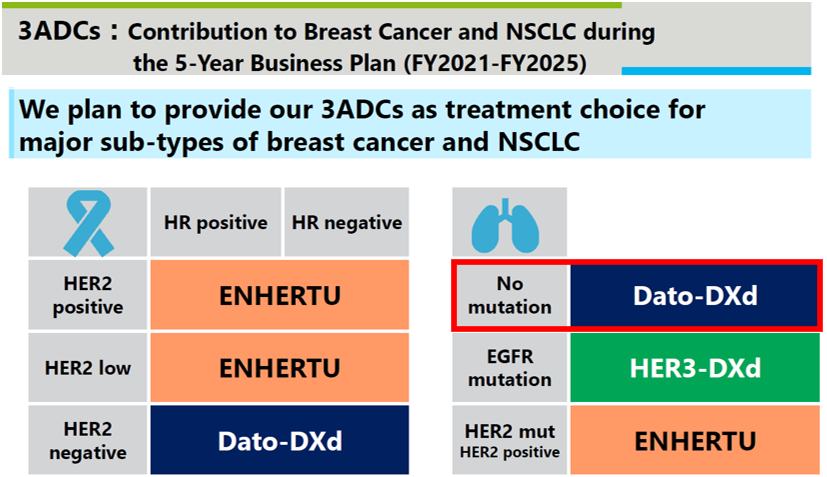
이번 유럽종양학회에서는 지난 TROPION-PanTumor01(NSCLC) 연구에 기초해 하위 분석(subset analysis)했다. 대상 환자군은 EGFR 돌연변이 85%, ALK 융합(9%), RET 융합(3%), ROS1 융합(3%) 등 '게놈 변경이 있는' 환자들이었다. 면역 치료(41%), 백금계 화학 항암제(91%), 타이로신 카이네이즈 저해제(85%) 등 다양한 약물을 경험했고 타그리소 투여 경험자는 69%였다.
실행 가능한 게놈 변경(Actionable Genomic Alteration)과
이중항체 (3)
앞에서 논의했듯이 비소세포암에서 특정 유전자 돌연변이가 있다면, 그에 따른 표적 치료제를 투여하고 별도의 유전자 돌연변이가 식별되지 않는 환자들은 항PD-(L)1 항체(혹은 + 화학 항암제)로 치료한다. 알려진 유전자 돌연변이가 있는 환자는 면역관문억제제 투여에 따른 효능이 거의 없는 것으로 알려져 있지만, 여전히 관련 연구를 진행하는 그룹이 있다.
중국 알파맵(Alphamab)의 KN046은 PD-L1과 CTLA-4를 타깃하는 이중항체(bsAb)이다. PD-(L)1과 CTLA-4 타깃 항체는 대표적인 면역관문억제제이고 몇몇 암종에서 단일 약물 혹은 병용요법을 통해 시너지를 발휘한 바 있다.
KN046은 화학 항암제 병용요법으로 실행 가능한 게놈 변경이 있는 비소세포폐암 1차 치료 임상시험 중이다. 이번 유럽종양학에서 초기 데이터를 발표했다. 항PD-(L)1 항체와 백금계 화학 항암제 병용요법은 PD-L1 양성 비소세포폐암 환자 대상 표준 치료제이지만, 특정 유전자 돌연변이가 있는 환자 대상 약물로 면역관문억제제를 활용하는 것은 이례적이다.
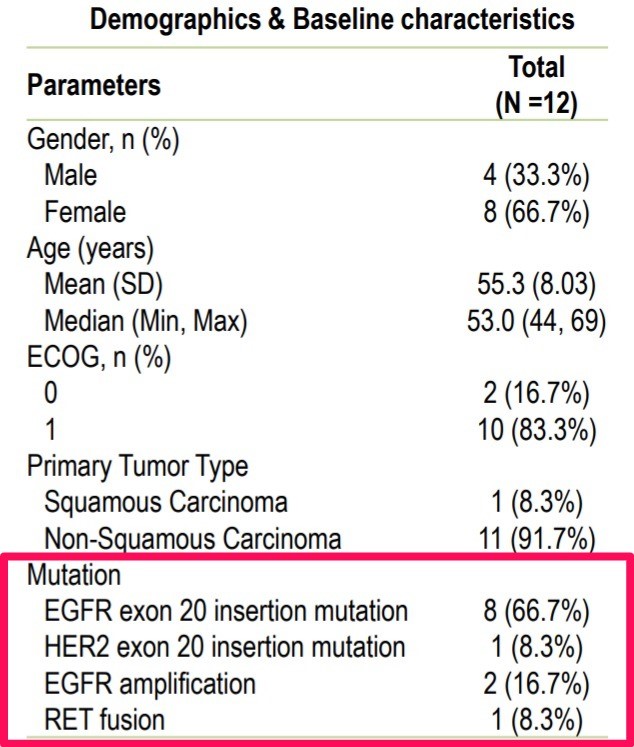
확인된 전체 반응률(ORR)은 50%(6/12)였고 무진행 생존기간 중앙값(mPFS)은 8.7 개월이었다. 또한 6개월 전체 생존률(OS)은 100%였다. 환자 규모가 작고 초기 데이터이지만, 의미있는 데이터로 볼 수 있다.
필자가 운영하고 있는 유튜브 채널 '가신길TV'에서는 몇 달 전 중국 진스크립트 프로바이오 민호성 대표님과 인터뷰를 진행한 적이 있다. 중국 바이오텍이 이중항체(bsAb), 항체약물접합체(ADC) 등에서 빠른 성장과 함께 혁신을 추구하고 있다는 논의를 했었다. 앞에서 언급한 알파맵도 이중항체로 혁신을 추구하는 대표적인 바이오텍으로 볼 수 있을 것이다.
화학 항암제가 배제된 위암 임상(Chemo-free regimens)
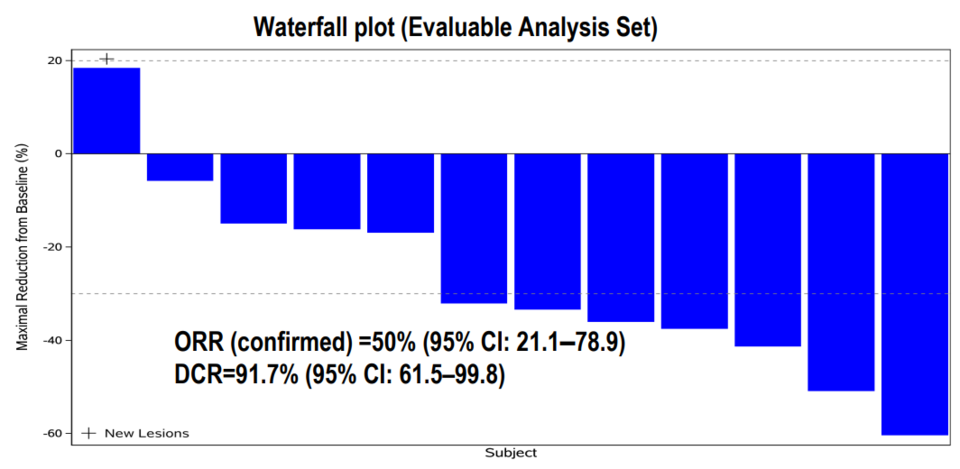
알파맵의 파이프라인에는 두 개의 HER2 도메인을 타깃하는 이중항체 KN026(HER2/HER2 biparatopic)도 있다. KN026(HER2/HER2)은 앞에서 언급한 KN046(PDL1/CTLA4)와 병용요법으로 위장관계 종양 환자 대상 임상을 진행하고 있고 이번 유럽종양학회에서 관련 데이터를 발표했다.
위 임상 연구가 흥미로운 것은 첫째, 이중항체 간 병용요법이라는 점이고 둘째, 현재 위암에서 승인된 약물 혹은 임상 중인 약물 중에 화학 항암제가 배제된 것은 좀처럼 찾기 힘들다는데 있다. 따라서 알파맵의 두 이중항체 병용요법은 화학 항암제 없이 면역관문억제제와 HER2 타깃 약물 간의 병용요법이라는 점에서 의미가 있다(chemo-free regimens).
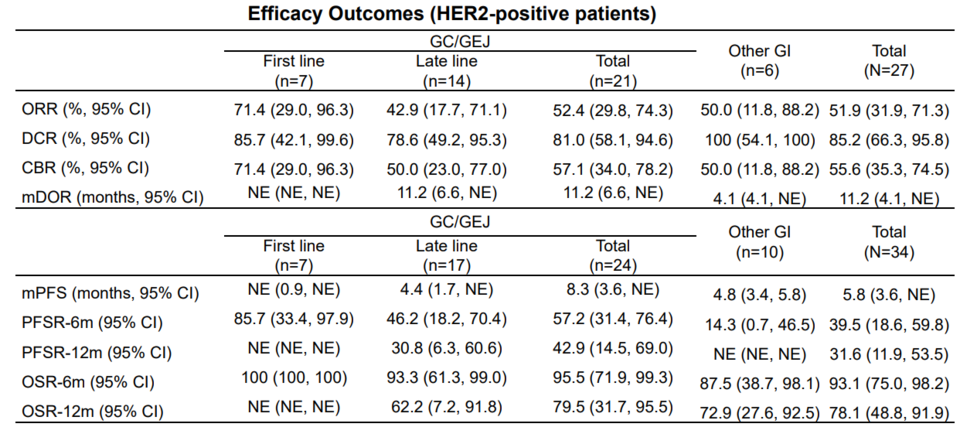
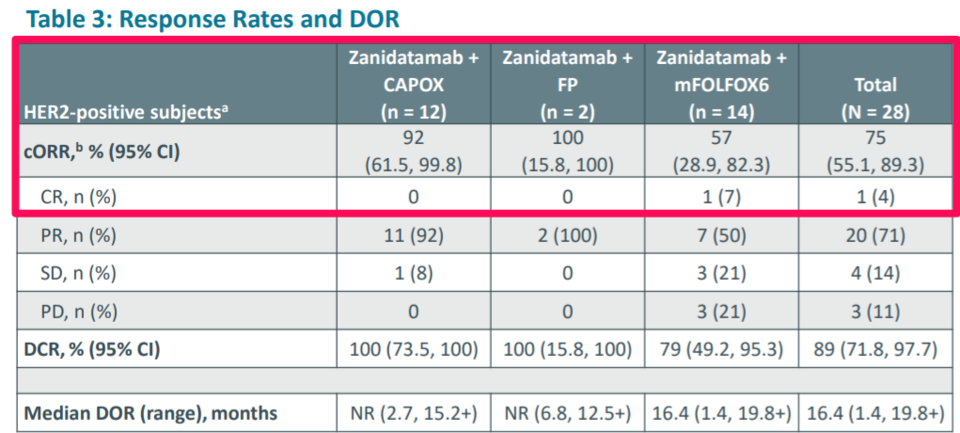
HER2/HER2 이중항체는 알파맵뿐만 아니라 캐나다의 자임웍스(Zymeworks)도 개발 중이다. 이들은 자사의 자니다타맙(zanidatamab)과 화학 항암제 병용요법으로 HER2 양성 위식도선암종(GEA)에서 임상시험 중이고 이번 유럽종양학회에서 관련 데이터를 발표했다(자니다타맙의 중화권 권리는 베이진 보유).
몇 개의 코호트에서 여러 화학 항암제와의 시너지를 탐색했는데 확인된 전체 반응률(ORR)은 75%였다(N=28). 약물의 반응 지속 기간 중앙값(mDOR)도 16.4 개월에 이르는 등 전체적으로 유망한 데이터를 도출했다. 이러한 데이터에 근거하여 자니다타맙 + 화학 항암제 병용요법은 글로벌 임상 3상을 앞두고 있다(Herizon-gea-01 연구).
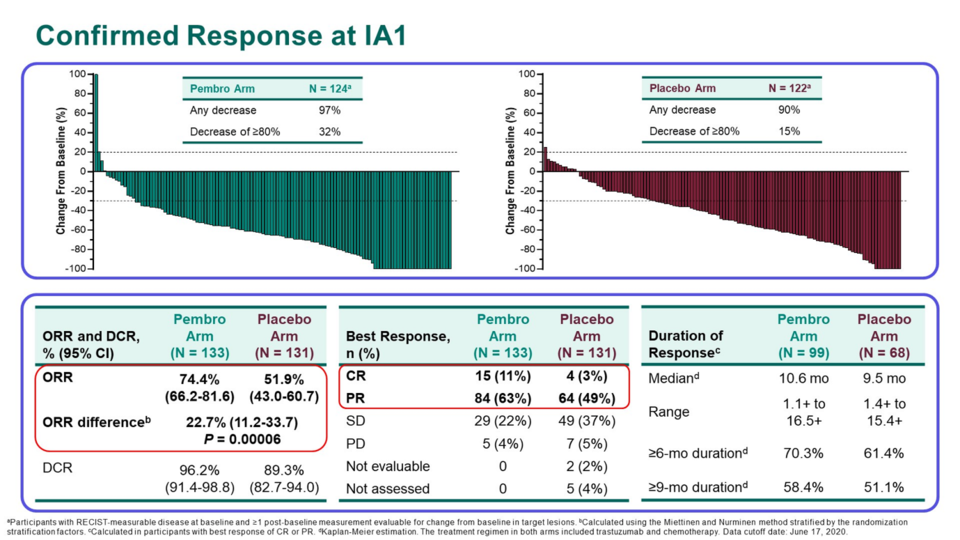
위 데이터의 의미를 좀 더 입체적으로 파악하기 위해 키트루다+허셉틴+화학 항암제 병용요법 연구였던 KEYNOTE-811 연구를 살펴볼 필요가 있다. 해당 연구에서 세 약물 조합은 전체 반응률(ORR) 74.4%를 도출했지만, 반응 지속 기간 중앙값(mDOR)은 10.6 개월이었다.
이는 해당 연구 대조군이었던 허셉틴+화학 항암제(HER2 양성 위암 1차 표준 약물)와 큰 차이가 없었다(9.5 개월). 우수한 반응률도 중요하지만, 향상된 약물 반응 지속 기간과 함께 유의한 생존 혜택을 확보하는 것이 중요한 과제일 것이다.
그런 맥락에서 자니다타맙이 허셉틴 대비 HER2 타깃 약물의 내성 매커니즘을 다소 지연시켜 줄 수도 있다는 점에서 기대해볼 수 있고 비록 초기 데이터이긴 하지만, 비교적 양호한 반응 지속 기간이 이를 방증한다.
CAR-T 세포 치료제, 고형암 도전기
지금까지 여러 CAR-T 세포 치료제는 혈액암 임상에서 의미 있는 결과를 도출했지만, 고형암에서는 그렇지 못했다. 이번 유럽종양학회에서 중국 카스젠(CARsgen)의 클라우딘18.2(Claudin18.2) 타깃 CAR-T 세포 치료제(CT041)는 위암·위식도접합부암을 대상으로 임상 데이터를 발표했다. 클라우딘18.2 타깃 약물은 단일클론항체, 이중항체, 항체 약물 접합체를 포함한 다양한 항체 기반 약물들이 임상 중이고 타깃 특성상 위암 혹은 췌장암 관련 임상 개발이 활발하다.
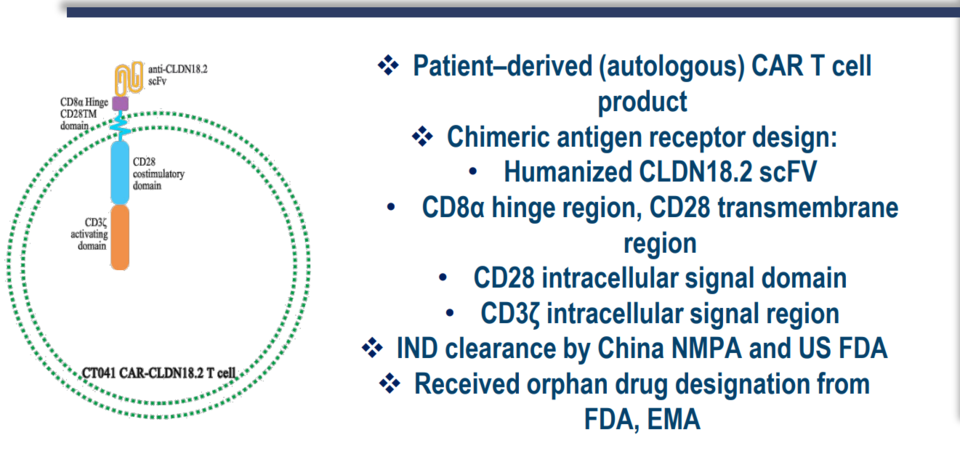
임상은 3개 용량을 투여했고 투여 환자의 클라우딘18.2 발현 수준은 다양했지만, 상대적으로 고발현 비율이 높았다(51.4%). 다양한 화학 항암제 투여 경험이 있었고 항PD-(L)항체 투여 경험자도 42.9%였다. 안전성 데이터 관련 3등급 이상 사이토카인 방출 증후군(CRS)과 신경 독성(ICANS)은 없었다.
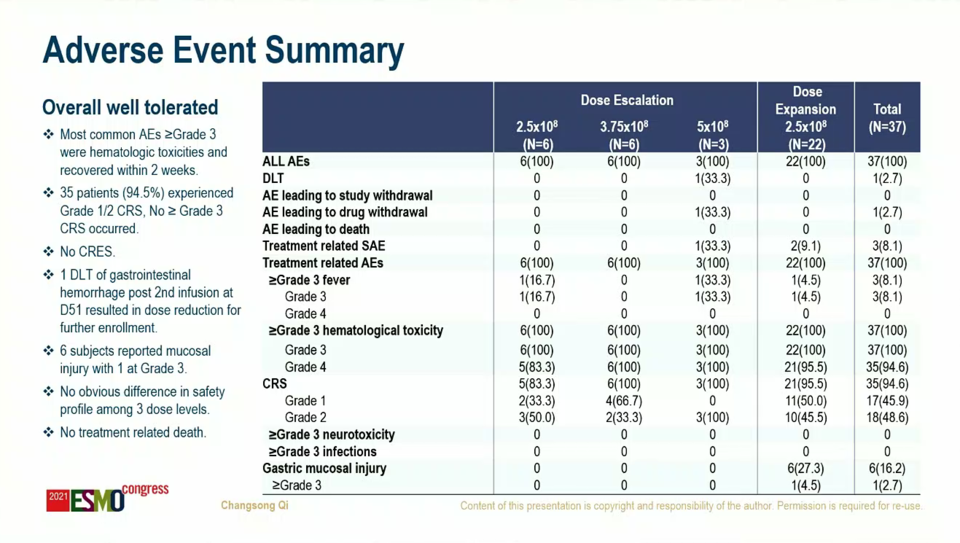
전체 반응률(ORR)은 48.6%(N=37)였다. 더불어 최소 2개 약물에 실패했으며 상당수 항PD-(L)1 투여 경험이 환자(N=18)의 전체 반응률은 61.1%(완전 반응은 없었음), 이들의 반응 지속 기간 중앙값(mDOR)은 6.4개월이었다. 클라우딘18.2 발현도, 항PD-(L)1 항체 투여 여부에 따른 반응률 차이는 크지 않았다.
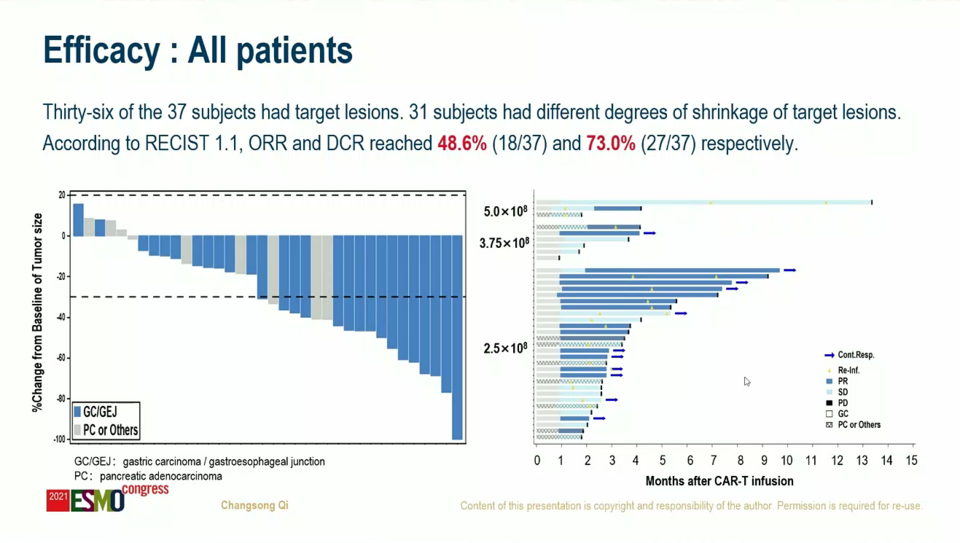
여러 그룹에서 CAR-T 세포 치료제로 고형암에 도전하고 있지만, 유의한 성과가 거의 없었던 상황에서 카스젠의 위암·위식도접합부암 환자 대상 데이터는 고무적이다. 카스젠뿐만 아니라, CAR-T 세포로 고형암에 도전하는 여러 그룹들을 잘 살펴보는 것은 이 분야의 혁신을 엿볼 수 있는 의미 있는 기회가 될 것이다.
이번 유럽종양학회에 발표된 포스터와 구두 발표를 모두 합치면, 약 3000개였다. 유럽종양학회 개막 전, 혼자만의 프리뷰를 준비하면서 주요 연구의 제목 정도는 다 살펴봤었다. 몇 개의 기준을 설정하여 선별했고 선별된 연구들은 좀 더 꼼꼼히 살펴봤다.
하다 보니 암종 중에서는 비소세포폐암, 위암에 집중되었고 모달리티 측면에서는 항체약물접합체와 이중항체에 집중된 편이다. 가급적 암종과 모달리티를 기계적으로 구분하지 않고 유기적으로 연결하여 논의하려고 했지만, 의도한대로 잘 된 것 같지는 않다. 전적으로 필자의 역량 부족 때문일 것이다. 본문에 담지 못한 이야기 중, 필자가 흥미롭게 살펴본 몇 개의 연구들을 간략히 소개하는 것으로 아쉬움을 달래고자 한다.
부록: 본문에 담지 못한 이야기
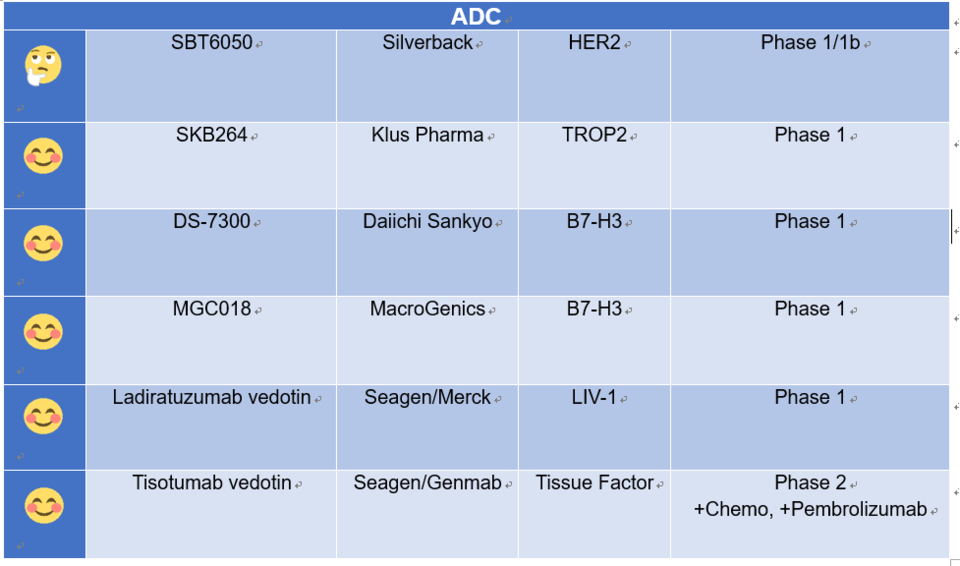
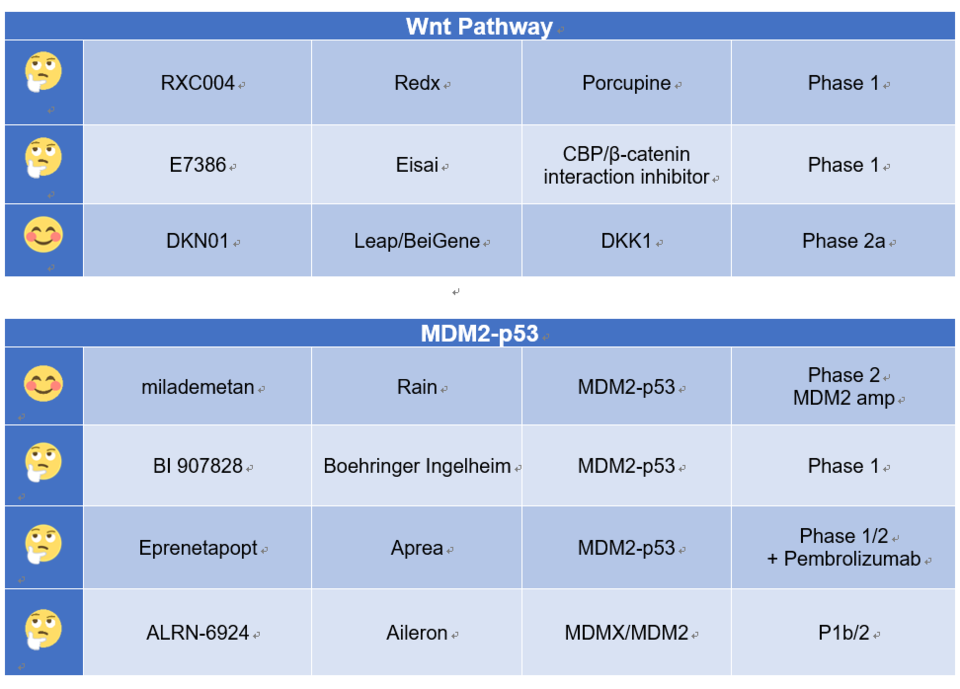
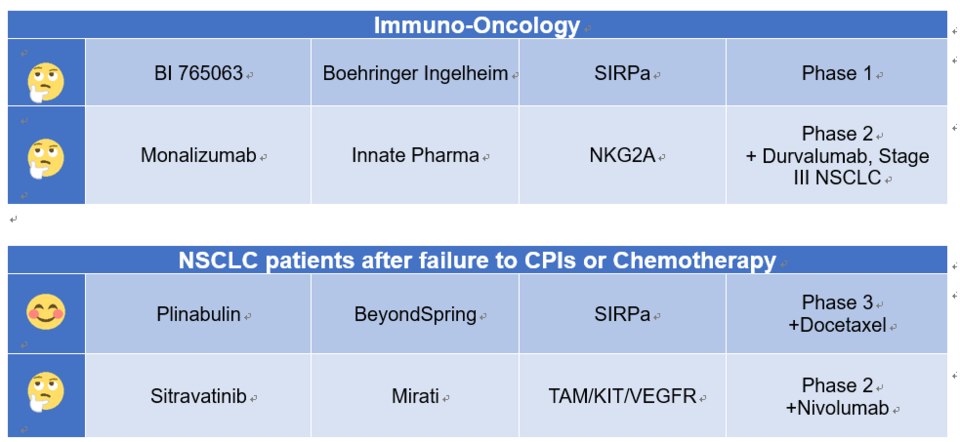
본 칼럼에서 논의하지 못한 연구 중, 필자가 의미 있게 본 것을 소개하고 이모지를 통해 간략한 평가도 덧붙였다. 필자의 개인적인 평가라는 점을 밝힌다.