복지부, 생명윤리 및 안전에 관한 법률 시행령 및 시행규칙 개정안 발표
10월 27일까지 의견수렴
소비자 대상 직접시행(DTC) 유전자검사 허용 기준이 고시사항에서 유전자검사기관 신청으로 완화되는 등 생명윤리법 하위법령 개정안이 공개됐다.
보건복지부는 2021년 12월 13일부터 시행될 '생명윤리 및 안전에 관한 법률'에서 위임한 하위법령을 담은 '생명윤리 및 안전에 관한 법률 시행령 및 시행규칙'을 17일 발표했다.
하위법령 주요 내용을 살펴보면 △유전자치료연구 기관위원회 심의기준 및 국가위원회 자문절차 마련 △신고목적 분류 및 요건 규정 △숙련도 평가 기준 마련 △DTC 유전자검사 절차 개편 등이 포함됐다.
종전 유전자치료 및 연구 질환은 유전질환, 암, 후천성면역결핍증 등 생명을 위협하거나 심각한 장애를 유발할 수 있는 질환으로 한정돼 있었으나 희귀난치성질환 치료연구 확대에 따라 연구 기준을 기관위원회 심의 및 국가생명윤리심의위원회 자문 등 기준을 제시하도록 했다.

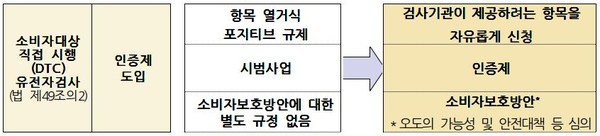
유전자검사기관 신고방식은 검사항목에서 목적에 따른 신고로 변경된다. 유전자 검사 목적은 △질병진단 및 치료 △질병 예측 △영양 생활습관 및 신체적 특징 △유전적 혈통 △개인식별 등 5개로 분류되며 시험기관은 이에 따른 시설 및 인력 기준을 충족해야 한다.
DTC 유전자검사는 검사항목이 고시로 규정된 항목에서 검사기관이 제공하려는 항목을 자유롭게 신청하도록 변경해 검사범위를 확대했다.
이외에도 이번 개정안에는 유전자검사기관 종사자 교육 의무화 생식세포 보존 기준이 일부 변경됐다.
이에따라 배아의 폐기기한을 30일에서 6개월로 연장하고 가임력 보존 등 기관위원회 승인 시 5년 이상 보존이 가능하게 된다.
복지부는 DTC 유전자검사 범위 확대 및 생식세포 보존관련 규정 개정을 통해 질적 수준을 확보한 유전자검사기관을 제공하는 한편 가임력 보존 및 난임치료, 배아·생식세포 연구에 대한 업계 요구를 반영해 나간다는 계획이다.
한편 복지부는 오는 10월 27일까지 개정안에 대한 개인·단체 의견수렴에 나선다.

