식약처, 1+3 개정규정 관련 Q&A 공개
공동개발 신고 시 공증된 계약서 제출해야

제네릭·개량신약 임상(생동)시험 자료 이용이 1+3으로 제한된다. 다만, 기존 10개사 또는 그 이상 회사에 자료를 허여했더라도 1+3 시행 이후 추가로 3개사까지 더 사용이 가능하다.
1+3 제한규정 시행 전부터 공동개발 중이었으나 시행 당시 임상시험계획 승인을 받지 못했을 경우에는 1+3 개정규정 적용을 받게 되니 유의해야 한다.
아울러 공동개발 신고는 8월 19일까지 해야 하며, 제품을 특정할 수 있는 정보 및 공동개발 추진 시 업무 또는 비용의 분담에 관한 사항을 포함한 공증된 계약서를 제출해야 한다.
히트뉴스가 식품의약품안전처의 동일 임상(생동)시험자료를 이용한 품목 수 제한 관련 Q&A를 정리했다.
1+3 제한, 동의 횟수는?
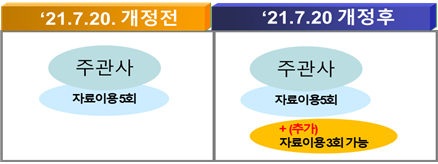
Q. 1+3 시행 전에 특정 임상(생동)시험자료를 사용하도록 여러 번 동의한 경우 더 이상 해당 자료를 이용하여 품목허가 등을 받을 수 없는지?
=1+3 시행 전에 특정 임상(생동)시험자료를 사용하도록 여러 번 동의한 경우라도 부칙 제11조에 따라 본 개정규정 1+3 시행 후부터 3회에 한하여 해당 임상(생동)시험자료를 사용할 수 있도록 추가 동의가 가능하다.
Q. 1+3 시행 전에 임상(생동)시험자료 사용을 동의 받아 품목허가를 신청하여 허가 심사 진행 중인 의약품에 대해서도 해당 자료사용 동의 횟수 산정에 포함되는지?
=부칙 제3조에 따르면 본 개정규정 1+3은 본 개정규정 1+3 시행 이후 품목허가를 신청하거나 품목신고를 한 경우부터 적용하도록 규정하고 있으므로, 본 개정규정 1+3 시행 전에 이미 품목허가를 신청해 허가 심사 중인 의약품에 대해서는 적용되지 않는다.
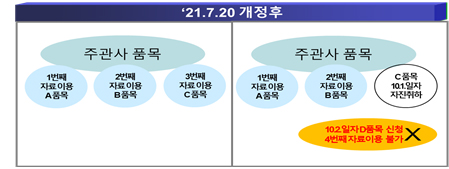
Q. 1+3 시행 이후에 동일한 임상(생동)시험자료의 사용 동의를 통해 허가된 3개의 의약품 중 1개가 품목취하되거나 품목취소되는 경우, 추가로 동의서를 이용해 품목허가 신청이 가능한 것인지?
「약사법」 제31조제11항 및 제13항에 따르면 임상(생동)시험자료를 작성한 자는 ‘3회에 한정’하여 해당 자료의 사용에 동의할 수 있다고 규정돼 있으므로, 임상(생동)시험자료 사용을 동의 받아 허가된 의약품 중 일부 품목이 취하·취소된 경우라도, 해당 임상(생동)시험자료를 작성한 자는 추가로 해당 자료의 사용에 동의할 수 없다.
제조소 변경허가 신청시에는?
Q. 1+3 시행 이전에 허가받은 제품의 제조소 변경허가를 신청하는 경우에도 본 개정규정 1+3 적용 대상이 되는 것인지?
=제조소를 변경해 변경허가를 신청하는 경우, 변경된 제조소에서 생산된 제품의 임상(생동)시험자료를 기반으로 변경허가를 받게 되므로 변경된 제조소의 임상(생동)시험자료를 작성한 자의 자료사용 동의에 따라 변경허가가 가능하다.
이 경우 앞선 답변에서와 같이 임상(생동)시험자료를 작성한 자는 부칙 제11조에 따라 본 개정규정 1+3 시행 후부터 3회에 한해 해당 임상(생동)시험자료를 사용할 수 있도록 추가 동의가 가능하다.
Q. 생물학적 동등성시험자료 대신 비교용출/비교붕해/이화학적동등성 시험자료 등 생체를 이용하지 아니한 시험자료를 제출하는 경우에도 본 개정규정 1+3이 적용되는지?
=생물학적 동등성시험자료의 제출 대신 비교용출/비교붕해/이화학적동등성 시험자료 등을 제출하는 경우에도 본 개정규정 1+3이 적용된다. 또한 전문의약품 중「첨단재생바이오법」에 따른 첨단바이오의약품, 생물학적 제제를 제외한 의약품에 대해서 모두 적용된다.
공동개발, 공증받은 계약서 필요
Q. 1+3 시행 당시 공동개발 중이었던 품목도 개정규정 1+3 적용 대상이 되는지?
=부칙 제10조에 따르면 본 개정규정 1+3 시행 당시에 다수의 의약품 제조업자가 공동개발하기로 하고 임상시험(생물학적동등성시험을 포함)계획 승인을 받은 의약품인 경우 공동개발한 의약품 제조업자가 공동개발 사실을 신고하면 본 개정규정 1+3의 적용을 받지 않는다.
아울러 개정규정 1+3 시행 전부터 공동개발 중이었다고 해도 1+3 시행 당시에 임상시험계획이 승인되지 않은 경우에는 본 개정규정의 적용을 받게 된다.
Q. 1+3 시행 전 공동개발하기로 하고 임상시험계획을 승인 받은 경우, ‘의약품 위탁제조판매업자’도 공동개발 사실을 신고해 1+3의 적용을 받지 않을 수 있나?
=부칙 제10조에 따르면 본 개정규정 1+3 시행 전 공동개발하기로 하고 임상시험계획을 승인 받은 의약품에 대해서는 공동개발하기로 한 ‘의약품 제조업자’에 한해 해당 규정을 적용받지 않도록 규정하고 있으나, 해당 규정의 취지상 의약품 제조업자 외에 ‘위탁제조판매업자’도 이에 포함해 해석할 수 있을 것으로 판단된다.
Q. 1+3 시행 전 공동개발하기로 하고 임상시험계획을 승인 받은 의약품에 대해 공동개발 사실을 신고하려는 경우 제출해 하는 자료는?
=1+3 시행 당시 의약품을 공동개발하기로 하고 임상시험계획 승인을 받은 자가 해당 사실을 신고하려는 경우, 공동개발 사실이 명확히 기재된 계약서 등을 공증 받아 제출해야 한다.
이 경우 공동개발 계약서에는 공동개발하려는 제품을 특정할 수 있는 정보 및 공동개발 추진 시 업무 또는 비용의 분담에 관한 사항이 포함돼야 하며, 계약서상의 공동개발자 정보는 이후에 품목허가를 신청하는 의약품의 제조업자 정보와 동일해야 한다.
공동개발 사실을 신고하려는 경우에는 의약품안전나라 홈페이지(nedrug.mfds.go.kr)에서 신고 내용을 작성한 후 관련 자료를 첨부하여 제출해야 한다.
Q. 1+3 시행 전 공동개발하기로 하고 임상시험계획을 승인받은 의약품에 대해 임상시험계획 승인을 받은 자가 공동개발을 신고한 경우, 각 공동개발자가 임상(생동)시험자료를 사용해 허가를 받고, 다시 각 공동개발자가 다른 업체에게 해당 임상(생동)시험자료를 사용하도록 3회씩 동의할 수 있는지?
=「약사법」 제31조제11항에 따르면 본 개정규정 1+3은 ‘임상시험자료를 작성한 자(즉, 임상시험계획을 승인받은 자)’가 3회에 한정해 타인에게 해당 자료의 사용에 동의할 수 있도록 한 것이므로, 임상시험자료를 작성한 자(즉, 임상시험계획을 승인받은 자)가 아닌 공동개발자는 다른 업체에게 해당 임상(생동)시험자료를 사용하도록 동의할 수 없다.

