식약처-임상시험지원재단, 의약품 임상시험 승인 현황 발표

작년 임상시험 전체 승인 건수가 799건으로 코로나19 감염병 위기 상황에도 불구하고 2019년 714건 대비 11.9%p 증가했다.
이와함께 우리나라의 임상시험 글로벌 순위는 6위로 2019년 8위보다 2단계 상승해 역대 최고 순위를 기록했다.
16일 식품의약품안전처(처장 김강립)와 국가임상시험지원재단(이사장 배병준)은 2020년 임상시험 승인현황을 공동 분석한 결과를 공개했다.
지난해 국내에서 승인된 임상시험의 주요 특징은 ▲임상시험 증가 ▲제약사의 초기단계 임상시험 급증 ▲항암제 및 감염병치료제(항생제 등) 분야 임상시험 증가 등으로 요약된다.
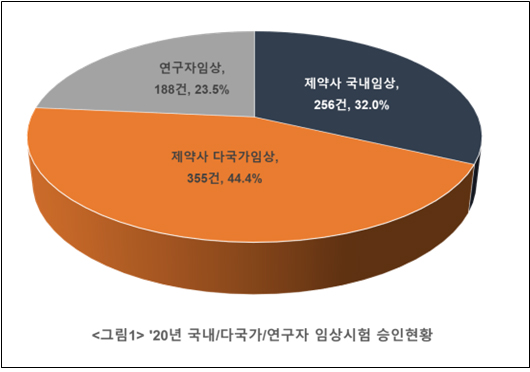
전체 임상 중 제약사 주도 임상 76.5% 차지
지난해 승인된 임상시험은 799건으로 2018년 679건, 2019년 714건까지 3년간 지속 증가했다.
특히 제약사 주도 임상시험이 611건(76.5%)으로 2019년 538건 대비 13.6%p 늘어 전체 임상시험의 증가를 견인한 것으로 나타났다.
제약사 주도 임상시험 611건을 단계별로 살펴보면 초기단계(1상‧2상) 중심으로 증가했다. 구체적으로 초기단계 임상 수는 2018년 309건에서 2019년 322건 작년 400건이었다.
그간 다국가 임상시험은 3상 비중이 절반 이상을 차지했으나, 지난해 처음으로 초기 임상시험(1·2상)이 3상보다 많은 비중을 기록했습니다.
다국가 임상시험 355건 중 3상 비중은 2018년 55.7%에서 2019년 55.2%, 지난해 45.1%를 차지한 반면 1·2상 비중은 2018년 43.9%에서 2019년 43.8.%, 작년 53.5%로 역전한 것이다.
항암제·감염병치료제 초기 임상 많아
효능별로는 항암제와 감염병치료제(항생제 등) 초기 임상시험이 많이 늘었다.
전 세계적으로도 항암제 개발이 증가되는 추세이며 코로나19 치료제·백신 개발도 활발하게 진행되고 있다.
항암제 1상·2상 임상시험은 2018년 109건에서 2019년 81건, 2020년 160건이었고, 감염병치료제 1상·2상 임상시험 건수는 같은 기간 동안 23건에서 15건, 42건으로 나타났다.
작년 글로벌 항암제 연구개발은 전년 5697건 대비 14.2%p 상승한 6504건으로 전체 제약사 연구개발의 36.7% 차지했다.
지난해에는 전 세계 임상시험도 증가했으며, 우리나라의 임상시험 글로벌 순위는 6위로 역대 최고 순위를 기록했다.
미국 NIH, 임상시험 등록 웹사이트에 따르면 전 세계 임상시험 등록 수를 보면 2018년 8386건, 2019년 8196건, 2020년 9028건으로 집계됐다.
우리나라 전체임상시험 글로벌 순위 6위
이에 따라 우리나라의 전체임상시험 글로벌 순위는 2018년 7위, 2019년 8위, 작년 6위를 차지했다.
이는 국내 임상시험의 증가, 다국가 임상시험의 약진은 우리나라가 코로나19로 인한 임상시험 환경변화에 신속하게 대처한 결과로 국내 임상시험 수행역량을 전 세계적으로 인정받고 있기 때문이며, 항암제 초기 임상시험의 증가는 말기암 등 대체 치료수단이 없는 환자에게 새로운 치료 기회를 마련할 수 있을 것으로 기대되고 있다.
국가임상시험지원재단(KoNECT) 배병준 이사장은 "국가감염병임상시험센터, 국가임상시험참여자플랫폼 운영으로 코로나19 임상시험 성공모델을 구축하고 임상시험 역량을 높일 수 있도록 적극적으로 지원할 계획"이라고 밝혔다.
식약처는 "앞으로 임상시험 참여자의 권익 보호 및 안전관리를 더욱 강화하는 한편, 임상시험 현장의 애로사항을 적극적으로 해소하고 중앙임상시험심사위원회(IRB) 운영 등을 통해 코로나19 치료제·백신의 신속한 개발을 적극 지원하겠다"고 말했다.

