임상시험·임상적 성능시험기관, 신규 인증 확인 필수
신청 가능 기관·교육 의무 등 새 기준도
체외진단의료기법 법령 시행으로 임상적 성능시험 및 임상시험 기관 역시 종전 의료기기 관련 인증과 별개로 체외진단기기 인증을 받아야 한다.
이에 따라 신규 체외진단기기의 임상적 성능시험 및 임상시험 기관을 찾으려는 업체는 기관의 승인 여부 확인이 필요할 것으로 보인다.
또한 검체검사기관 역시 임상적 성능시험기관으로 이정 받은 이후 임상적 성능시험이 가능해 업체의 기관 선택에 주의가 필요하다.
식품의약품안전처가 지난 22일 발표한 '체외진단의료기기 법령 시행에 따른 업무 안내서'를 살펴보면, 체외진단의료기기 임상적 성능시험 및 임상시험 기관은 체외진단의료기기법 시행 이후 1년 이내에 체외진단의료기기 시험기관으로 신규 지정을 받아야 한다.
임상적 성능시험기관은 제외진단의료기기법 제7초 및 제8조에 따라 체외진단의료기기로 임상적 성능시험을 하려는 이가 시험을 요청할 수 있는 기관으로 종전 의료기관, 혈액원에서 보경환경연구원, 진단검사의학 또는 병리학 분야의 과목이 개설된 의과대학, 진단검사의학과 또는 병리과 전문의가 상근하는 검체 분석·검사 기관이다.
이 중 검체분석·검사 기관은 현재 진행 중인 시험을 완료는 가능하나 신규 승인을 받지 않을 경우 신규시험 접수는 불가능하다.
다만 의료기관에서 진단 또는 치료 목적으로 사용하고 남아있는 인체 유래 검체를 제공하고자 하는 검체제공기관은 검체 채취 여부에 따라 승인의무가 달라진다.
임상적 성능시험계획에 따라 검체를 재취하기 위해 대상자의 동이, 등록 및 검체 채취 등을 수행하는 경우는 임상적 성능시험기관으로 지정을 받아야 한다.
지정절차는 크게 신청서 작성, 접수, 평가, 발급 으로 구분되며 지정 승인에 필요한 서류는 ▲인증 신청 가능기관 증명, ▲시설 전문인력, 기구가 지정기준 적합, ▲사무운영규정 및 심사위원회 구성·운영 증빙, ▲최근 2년간 임상적 성능시험 실적자료 등이다.
식약처는 "체외진단의료기기 임상적 성능시험계획 승인에 관한 규정을 참고해 임상적 성능시험 계획서에 검체 수급기관, 검체 수급 담당자 등을 확인해야 한다"며 "그 외 사항은 생명윤리 및 안전에 관한 법률'에 따른 절차를 준수해야 한다"고 설명했다.
종사자 교육 의무도 신설됐다. 임상적 성능시험기관으로 지정받은 기관 관련 심사자, 시험책임자, 시험담당자는 2021년부터 연간 8시간의 종사자 교육을 이수해야 한다.
단, 임상시험기관과 임상적 성능시험기관을 겸직하는 종사자의 경우 유사과목에 한해 교육시간 대체가 인정 가능하다.
식약처는 "한국의료기기안전정보원에 교육프로그램 개발·운영을 위탁해 2021년 1월 1일부터 운영할 계획"이라 설명했다.
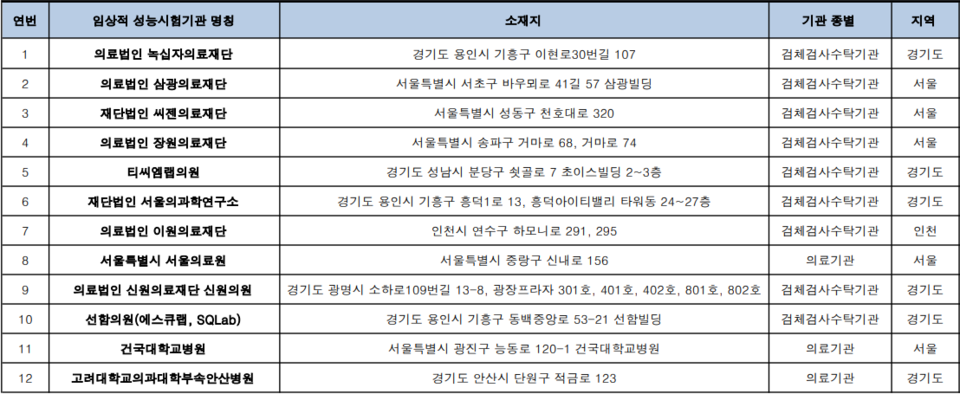
12월 8일 기준, 식약처 승인을 받은 임상적 성능시험기관은 총 12개로 녹십자의료재단, 삼광의료재단, 씨젠의료재단 등이 포함돼 있다.