천식 조절되지 않는 환자 위한 어택트라·에너제어
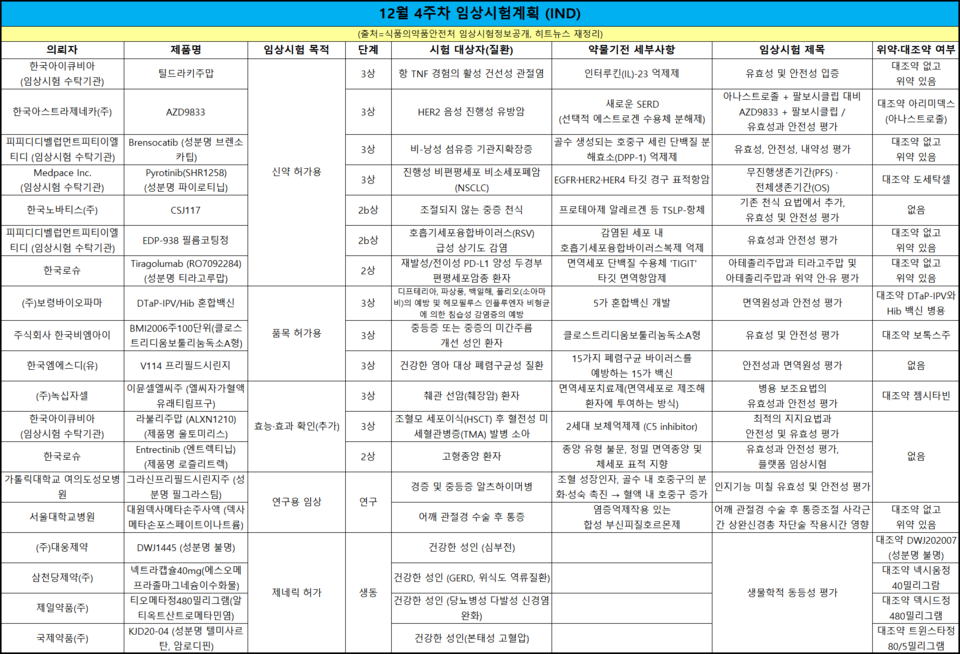
MSD 폐렴구균백신 후보, 소아대상 국내 3상 착수
한 눈에 보는 임상 승인·품목 허가 - 12월 4주차 (12.21~25.)

증상 악화와 기존 치료요법으로 증상 조절되지 않는 천식 환자를 위해 노바티스가 새 천식 치료 옵션을 선보인다. 환인제약과 휴온스는 각각 CNS(정신신경계) 질환 치료 시장에서 입지 넓힐 전략을 펼치고 있다.
MSD의 폐렴구균 백신 후보물질이 국내 영아 대상으로 임상 3상을 진행한다. 시장을 화이자 '프리베나13'가 장악했데 경쟁자가 되겠다는 판단이다. GC녹십자셀은 간암치료 세포치료제 '이뮨셀엘씨'로 췌장암 적응증 확대를 위한 임상에 나선다.
LABA+LAMA+ICS 조합… 노바티스 천식 약은 새 옵션
CNS 입지 넓히려는 환인제약·휴온스, 불면증 약 '연합'
지난 한 주 34품목이 신규 허가 받았고, 이중 자료제출의약품이 5품목이었다. 새로운 조성이라는 이유에서다. 노바티스는 천식 복합제 ▲어택트라흡입용캡슐 ▲에너제어흡입용캡슐을 허가받았다.
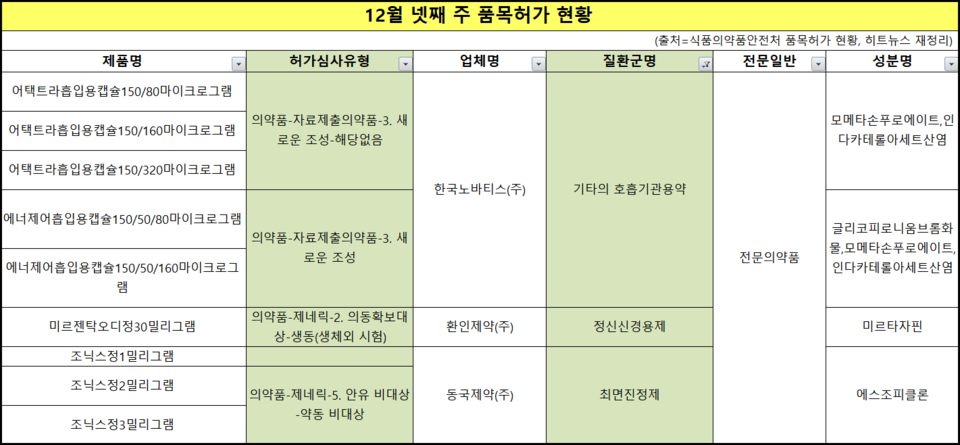
어택트라는 모메타손푸로에이트, 인다카테롤아세트산염 2제 복합제고 에너제어는 두 성분에 글리코피로니움브롬화물이 추가로 조합된 3제 복합제다.
비염, 급성 비부비동염 치료에 쓰이는 '모메타손'과 베타 투 수용체에 선택적으로 작용하는 효능제로 천식 환자의 기관지 확장과 만성 폐쇄성 폐 질환 치료에 쓰이는 '인다카테롤' 조합은 기존에 없던 새 조성이다.

그런데 에너제어는 천식 환자들에게 장기지속형 베타2 촉진제(LABA), 장기지속형 무스카린 길항제(LAMA) 및 흡입형 코르티코스테로이드제(ICS)의 복합제다.
LABA와 ICS의 병용 유지로도 적절히 조절되지 않는 환자를 위한 치료 옵션이다.
유럽에서는 '에너제어'가 브리즈헬러 제형으로 디지털 동반 센서와 어플리케이션을 사용할 수 있도록 올 7월 허가를 받았다. 센서와 앱으로 흡입 유무를 확인하고, 복용시간을 알려주면서 치료 결정을 도울 객관적인 자료로 쓰일 수 있다.
환인제약은 미르타자핀 오디(구강붕해)정 라인업을 추가하고 있다. 미르젠탁오디정 15밀리그램과 30밀리그램을 각각 허가받았다. 미르타자핀오디정의 오리지널은 MSD '레메론'이 오리지널 의약품으로, 지난 2014년 명인제약이 밀타오디정을 허가받아 발매하고 있다.
환인제약이 조금 늦게 뛰어든 것이지만 CNS 분야에서 다양한 치료제를 확보하겠다는 의지로 풀이된다. 올 초부터 파킨슨병 치료제, 우울증 치료제, 불면증 치료제 등 라인업 확장에 적극 나서고 있다.
환인제약이 에스조피클론 성분 '조피타정' 수탁을 맡긴 제약사는 휴온스다. 휴온스는 에스조피클론 제제 수탁생산을 계속 늘리고 있어 불면증 치료제 시장 입지를 넓힐 전망이다. 자사 '조피스타'에 이어 환인제약, 영진약품, 최근 동국제약 수탁을 맡았다.

지난 3월 명인제약이 조스정을 허가받고 발매에 나서, 휴온스가 시장 방어전략을 세운 것으로 풀이된다. 에스조피클론은 장기 복용이 가능하다. 임상을 통해 수 개월 간 복용해도 의존성이 적고 지속적인 수면 유도 및 유지 효과가 확인됐다.
폐렴구균 백신에, 보툴리눔 톡신에 도전장 내미는 업체들
녹십자셀 이뮨셀엘씨, 췌장암 보조요법 적응증 추가 목표
한 주간 승인된 임상시험은 19건이다. 목적에 따라 ▲신약 허가용 8건 ▲품목 허가용 3건 ▲효능·효과 확인(추가) 3건 ▲연구용 임상 2건 ▲제네릭 허가 4건이다.
MSD의 폐렴구균 백신 후보물질이 국내 건강한 영아 대상으로 임상 3상을 진행한다. 상업화를 염두에 둔 과정으로 화이자 '프리베나13'이 국내 시장을 삼킨 가운데 MSD가 도전장을 내밀 전망이다. 개발명은 'V114 프리필드시린지'다.
임상은 국내 18개 의료기관에서 100명의 영아 대상으로 V114의 4회 투여 시 안전성과 면역원성을 평가한다. V114는 15가지 폐렴구균 바이러스를 예방하는 15가 백신으로, 성인과 소아 대상으로 임상시험을 진행했다.

국내에서는 화이자 13가 폐렴구균백신 '프리베나13'이 아이큐비아 기준 504억원의 실적을 올리고 있다. GSK의 폐렴구균백신 신플로릭스(61억원)와 격차가 크다. SK바이오사이언스가 후발약 '스카이뉴모'를 개발했으나 특허를 회피하지 못해 허가를 취하하기도 했다. 시장 변화는 MSD의 V114 시판 이후를 지켜봐야 한다.
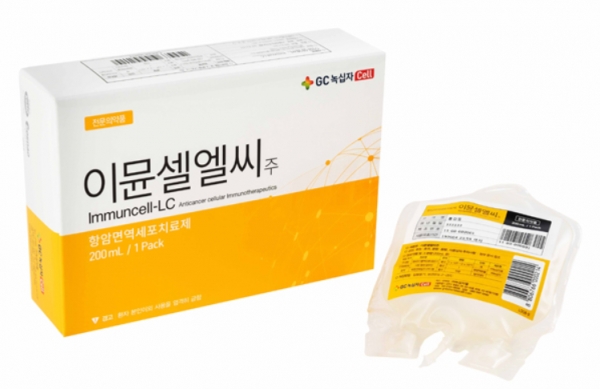
GC녹십자셀은 세포치료제 '이뮨셀엘씨'의 적응증 확대목적 3상에 돌입한다.
췌관선암 환자에서 절제수술 후 젬시타빈과 병용요법으로 진행한다. 젬시타빈 단독 보조요법 대비 유효성(재발 및 암진행 억제와 생존효과)과 안전성을 평가한다.
향후 66개월 가량 소요될 전망이지만 췌장암 5년 상대생존율이 12.2%로 다른 암종에 비해 예후가 좋지 않은 데다 현재 젬시타빈 이후 뚜렷한 췌장암 항암제가 없는 실정이다. 회사는 '췌장암 병용요법 적응증'을 허가받겠다는 계획이다.
이뮨셀엘씨는 현재 간암 보조요법으로 허가됐고 환자 혈액에서 '면역세포'를 추출한 후 배양해 항암능력을 높일 '면역세포'로 만들어 다시 주사한다. 지난해 357억 원의 판매실적을 올리며 국내 세포치료제 매출 1위를 기록하고 있다.
국내 바이오벤처의 보툴리눔 톡신 사업 의지가 뚜렷한 모양새다. 한국비엠아이는 보툴리눔 톡신 제제 'BMI2006주100단위(클로로스트리디움보툴리눔독소A형)'의 임상 3상을 승인받았다. 중등증 또는 중증 미간주름 개선이 필요한 성인 환자를 대상으로 보톡스주와 안전성 및 미간주름 개선 효과를 비교 평가한다.
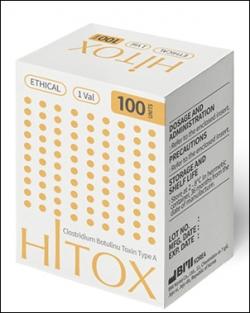
한국비엔씨와 완제 개발과 생산을 위해 협업을 계속해오고 있다. 한국비엔씨는 '비에녹스(BIENOX)', 한국비엠아이는 '하이톡스(Hitox)'라는 품목명으로 지난 1월 획득했었다. 후발주자라 기존 제품과 차별화된 적응증을 취득하겠다는 목표다.
보툴리눔 톡신 시장에 진출하려는 국내 업체들은 줄잇고 있다. 지난 9월 기준 국내 허가받은 보툴리눔 톡신 제제는 29품목, 업체는 14개사에 이른다. 유망 시장이라는 판단에 진출하려는 것인데, 허가받고 발매해 성과를 얻을 지는 봐야 한다.

