식약처·복지부 '의료기기 허가·신의료기술평가 등 통합운영' 개정 고시
식품의약품안전처(처장 김강립)와 보건복지부(장관 박능후)는 의료기기 허가 진행 중에도 급여·비급여 대상 여부 확인과 신의료기술평가를 동시에 받을 수 있도록 '통합심사 전환제'를 오늘(10일)부터 시행한다.
두 부처는 공동으로 '의료기기 허가·신의료기술평가 등 통합운영'을 개정 고시했다.
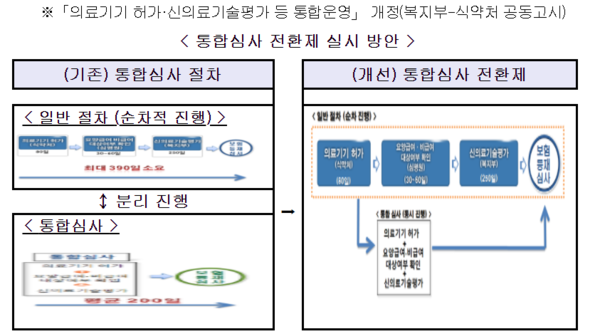
'통합심사'는 의료기기의 시장진입 기간을 단축하기 위해 단계별로 거쳐야 했던 과정들을 병렬적으로 동시에 진행할 수 있도록 창구를 식약처로 일원화하는 제도다.
통합심사 신청 시 ①의료기기 허가(식약처), ②급여·비급여 대상 여부(건강보험심사평가원) 및 ③신의료기술평가(보건의료연구원)의 심사를 진행한다.
기존 통합심사는 의료기기 허가 신청 시, 요양(비)급여 대상 여부 심사 및 신의료기술평가 자료를 동시에 제출하는 경우에만 통합심사 신청이 가능했다.
의료기기 허가 신청 후 심사 진행 중에 통합심사 신청이 가능하도록 하는 '통합심사 전환제'를 지난해 9월부터 시범운영한 데 이어, 이번 고시 개정으로 전면 시행한다.
이번 개정으로 ▲「체외진단의료기기법」에 따른 체외진단의료기기도 통합운영 제도 신청도 가능해 졌다. 이와함께 ▲통합심사 운영 안정화를 위해 신의료기술평가위원회 참석가능 대상을 확대했고 ▲각 단계별 통합운영 중단사유 발생 시 각 기관의 불필요한 업무 방지를 위한 안정적 종료가 이뤄 질 수 있도록 개선했다.
식품의약품안전처와 보건복지부는 "이번 개정을 통해 의료기기 시장 진입을 위한 만반의 준비를 갖춘 업체들이 보다 편리하게 통합심사를 신청할 수 있도록 해, 의료기기의 시장진입 기간이 단축될 것"이라고 했다.ㄱ

