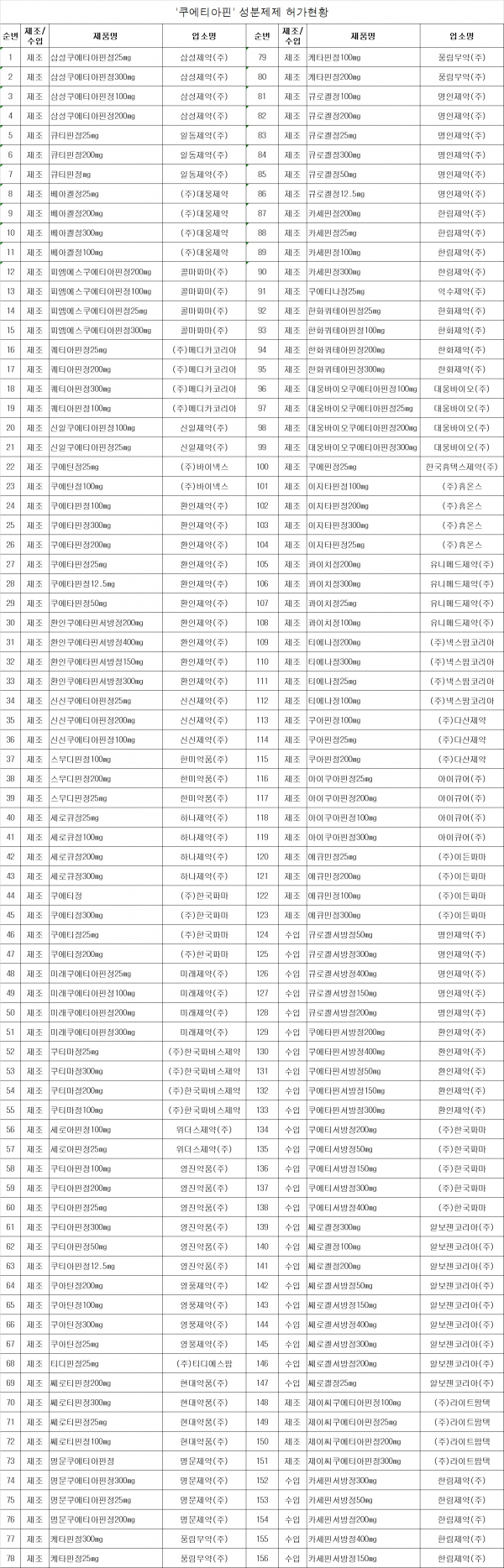
식약처, 알보젠코리아 '쎄로켈정300mg' 등 35개사 156품목 허가사항 변경
알보젠코리아의 '쎄로켈정300mg' 등 조현병치료제 '쿠에티아핀' 성분제제의 이상반응에 '간부전'이 보고돼 허가사항이 변경된다.

식품의약품안전처는 '쿠에티아핀' 성분 제제의 미국 식품의약품청(FDA) 안전성 정보와 관련해 국내·외 허가 현황, 제출의견 등을 종합 검토한 결과에 따라 9월 10일자로 35개사 156품목에 대한 허가사항 변경지시를 내렸다고 밝혔다.
'쿠에티아핀'은 조현증과 양극성 장애 치료제이다. 중추신경계에서 기분과 행동을 조절하는 신경전달물질의 과잉 활성을 억제하여 항정신병 작용을 나타낸다. 대표적인 부작용은 어지러움, 졸음, 기립성 저혈압 등이다
'쿠에티아핀' 성분 제제의 미국 식품의약품청(FDA) 안전성 정보에 따르면 '간부전' 이상반응이 발생했다.
기존 허가사항상의 이상반응은 AST 증가, 혈소판 감소, 비결합형 T3 감소, 혈중 크레아틴 인산 효소 증가, 무과립구증, 간염, 요저류 등이었다.
'쿠에티아핀' 성분제제의 오리지널 의약품인 '쎄로켈'정은 한국아스트라제네카의 제품이었으나 지난 5월 알보젠코리아가 인수했다.
한편, '쿠에티아핀' 성분 제제는 올해초 유럽 의약품청(EMA)의 '쿠에티아핀' 성분제제 관련 안전성 정보에 대한 검토결과에 따라 식약처가 하가사항을 변경한 바 있다.
유럽 의약품청(EMA)의 '쿠에티아핀' 성분제제 관련 안전성 정보에 따라 식약처는 이상반응항에 '스티븐스-존슨 증후군(SJS), 독성 표피 괴사(TEN), 호산구증 및 전신증상을 동반한 약물반응 (DRESS)을 포함한 중증 피부 유해 반응(SCAR)이 보고되었다'는 내용을 신설하도록 했었다.