"美 FDA, 한국 키트 적절치 않아 사용 반대" 보도 관련 설명
식약처 "진단정확도 모니터링 중… 오류 보고된 바 없어"
FDA가 긴급사용 승인한 진단키트도 유전자 검출 방식
식품의약품안전처가 "미국 의회는 한국산 코로나19 진단키트 사용에 대해 적절치 않다는 입장을 밝혔다"는 언론보도에 대해 설명에 나섰다.

해당 보도에서 문제 제기된 항체검사방법은 국내 제품이 아니며 현재까지 진단 오류에 대한 부작용은 보고된 바 없다는 것이다.
식약처는 15일 한국일보의 '미 FDA "한국 코로나키트, 비상용으로도 적절하지 않다' 보도에 대해 이같은 설명자료를 배포했다.
한국일보는 "美 하원 청문회에서 마크 그린의원은 한국의 진단키트는 적절하지 않으며 美 FDA는 이 제품이 미국에서 사용되는 것에 동의하지 않는다"고 보도했다.
외신 보도 등에 따르면 그린 의원은 청문회를 통해 미국의 진단키트가 정확성이 더 높다면서 한국은 단일면역글로불린항체(lg)만을 검사한다고 주장했다.
이에 대해 식약처는 "현재 국내 긴급사용 승인된 5개 코로나19 진단시약은 모두 유전자 검출검사법(real-time RT PCR)을 사용하는 제품"이라며 "식약처와 질병관리본부의 검증을 받았다"고 했다.
한국일보 보도에서 문제 제기된 항체검사방법은 국내 긴급승인돼 사용 중인 제품이 아니라는 게 식약처 설명이다.
그러면서 "해당 제품들의 진단정확도는 대한진단검사의학회를 통해 모니터링 하고 있다"며 "현재까지 진단오류에 대한 부작용은 보고된 바 없다"고 했다.
식약처는 "美 FDA에서 긴급사용 승인한 4개의 코로나19 진단제품도 국내와 동일하게 유전자 검출방식을 사용한 것"이라고 강조했다.

권준욱 중앙방역대책본부(이하 방대본) 부본부장(국립보건연구원장)도 15일 오전 방대본 정례브리핑 자리에서 "미국의 주장은 사실이 아니"라고 했다.
권 부본부장은 "진단단계 정확성과 신뢰도에 대한 잘못된 정보가 있는 것으로 보고 있다"며 "미 FDA나 이를 이용한 의원의 발언이 와전됐을 수 있다"고 했다.
질본은 WHO 권고에 따라 RT-PCR을 통해 코로나19를 진단하고 있다. 환자 검체 속 코로나19 바이러스 DNA를 증폭시켜 바이러스 유무를 파악하는 것.
이어 "현재 어느 나라도 항체검사, 바이러스 항원검사, 바이러스 자체 분리, 신속진단 방법으로 진단하고 있지 않다"고 했다.
또, 신속진단법은 민감도와 특이도 등이 검증되지 않아 시간소요, 정확성과 신뢰도에 대해 문제 제기되고 있다는 게 방대본의 판단이다.
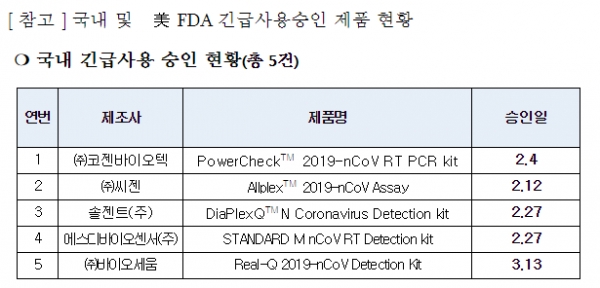
한편, 국내에 긴급사용 승인 된 진단 시약은 ▷PowerCheckTM 2019-nCoV RT PCR kit (코젠바이오텍) ▷AllplexTM 2019-nCoV Assay (씨젠) ▷DiaPlexQTM N Coronavirus Detection kit (솔젠트) ▷STANDARD M nCoV RT Detection kit (에스디바이오센터) ▷Real-Q 2019-nCoV Detection Kit (바이오세움) 등 5개사 5품목이다.
관련기사
- 셀트리온의 코19 20분 진단키트에 업계 "정확도 회의적"
- 셀트리온 "200억 투입 6개월 내 '코19 치료제' 임상진입"
- "과거 방식의 방역은 쉽고, 고통도 적다"
- 휴온스-젠큐릭스, 코로나19 진단키트 전세계 공급
- 코19로 촉발된 의료제품 개발…그 이후를 구상할 때
- 진매트릭스, 코로나19 진단키트로 유럽 진출
- 코19 진단시약, 잇단 증산·사용승인…"공급 충분할 듯"
- 美 백신 포함 코로나19 약물 중재 임상시험 56건 진행
- 긴급사용승인된 코로나19 진단시약, 52만 명분 생산
- 생활치료센터 입소 환자, 하루새 196명 완치 판정
- 한국 코19 진단시약, 제품력 인정… 해외 수출 '파란불'
- "코19 임상검체 수송배지 첫 수출… UAE, 5만개 구매"
- 정부 '코19 브리핑'도 온라인으로… "질문은 카톡방에서"
- GC녹십자엠에스-진캐스트, DNA 활용 코19 진단시약 '맞손'
- 국산 진단키트 3개 제품, FDA 긴급사용 사전승인 획득
- 한국이 제안한 코19 등 감염병 진단기법, 국제표준 된다
- 솔젠트, 미 연방재난관리청 '코19 진단키트' 공급업체 등록
- 씨티씨바이오, 코19 진단키트 기술도입… 생산 준비 중

