|임상승인 현황| (2019.12.23.~2020.01.03.)
식약처, 2주간 총 37건 승인
'키트루다-렌비마' 병용 임상도
최근 2주간 30건의 임상시험이 승인됐다. 일동제약은 도입신약인 편두통신약 '라스미디탄'의 3상 임상시험을 시작한다. 태준제약은 안구건조증 치료제 개발에 나섰고, 삼양바이오팜은 항암제 '나녹셀엠주'의 용법·용량 변경을 위한 임상에 나선다.
면역항암제 '키트루다'와 표적항암제 '렌비마'의 병용 임상도 새로 승인받았다.
4일 식품의약품안전처 '의약품 안전나라' 임상시험 정보공개에 따르면 지난해 12월 23일부터 이달 3일까지 신규 승인된 임상시험 건수는 총 30건이었다. 신청인(중복 포함)별로는 ▷제약바이오기업 20건 ▷의료기관 7건 ▷CRO(임상시험수탁 기관) 3건이었다. 제약바이오기업의 경우 ▷국내사 25건 ▷다국적사 5건으로 집계됐다. 시험단계별로는 ▷1상 8건 ▷3상 7건 ▷연구자 임상시험 6건 ▷생동성 시험 4건 ▷2상 3건 ▷1b상 · 2a상 각 1건 등의 순이었다.
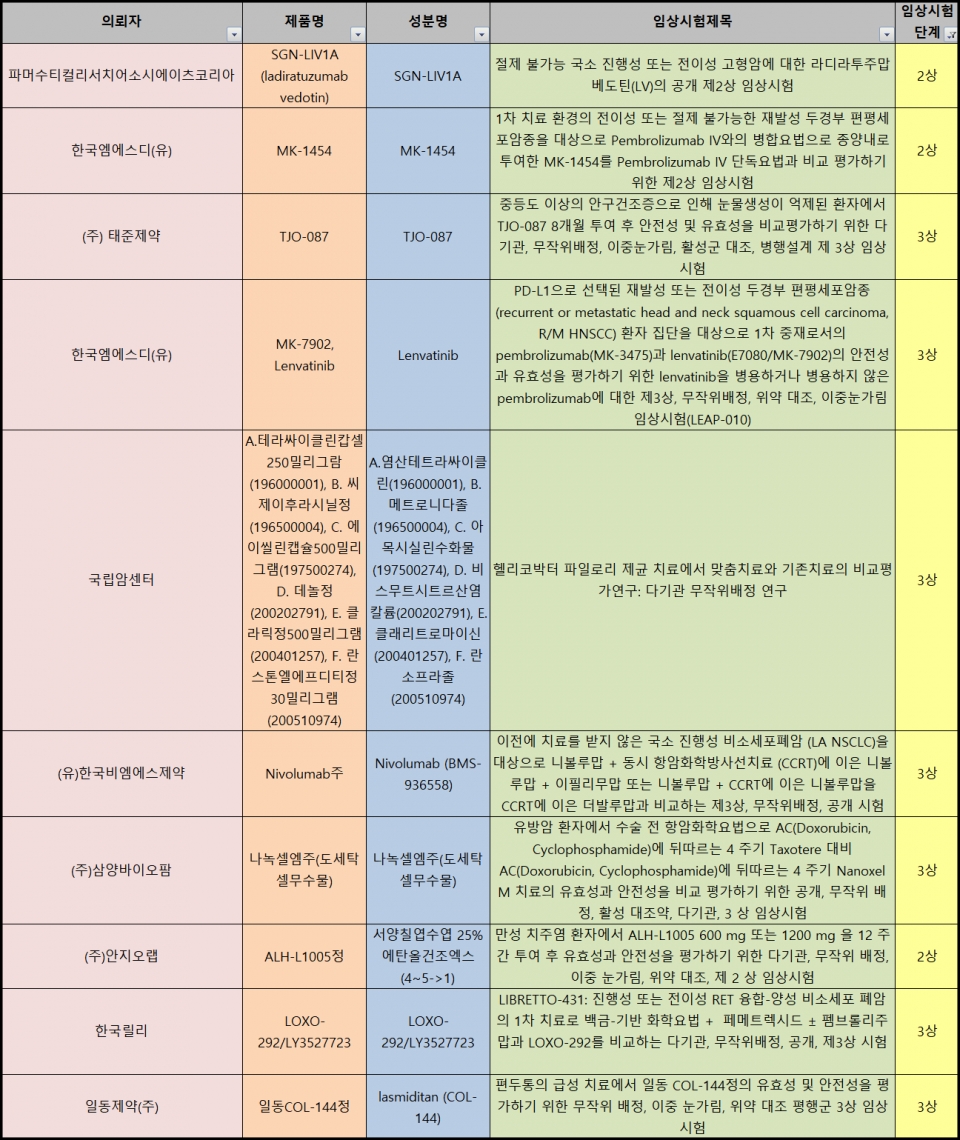

일동제약은 지난달 23일 편두통 신약 후보물질 '일동COL-144정(성분명 라스미디탄)'의 임상 3상을 승인받았다. 편두통의 급성 치료에서 유효성 및 안전성을 평가하기 위해 을지대학교 을지병원에서 진행한다. 이미 일동제약은 지난해 6월부터 약동학과 안전성을 평가하기 위한 임상 1상 가교 시험을 승인받고 진행하고 있다. 지난 2013년 릴리로부터 한국과 아세안 8개국의 판권을 도입했다.
릴리는 지난해 10월 미 FDA의 승인을 받았는데 전조증상 유무와 관계없이 사용할 수 있는 급성 편두통 치료제로 관심을 모았다.
태준제약은 안구건조증 환자 대상 임상을 승인받고 치료제 개발에 나선다. 지난 2일 식약처에 'TJO-087'에 대한 임상 3상을 승인받았다. 중증도 이상 안구건조증으로 눈물 생성이 억제된 환자에게 'TJO-087'을 8개월 투여 후 안전성과 유효성을 평가한다.

(사진출처 : 삼양바이오팜 제품 소개)
삼양바이오팜은 2012년 시판허가를 받은 항암제 '나녹셀엠주(성분명 도세탁셀무수물)'을 대상으로 신규 임상 3상을 지난 24일 승인받았다. 나녹셀엠주는 유방암을 비롯해 전립선암, 난소암, 두경부암, 소화기암 등 각종 종양의 치료에 쓰인다. 암세포 증식을 억제해 항암작용을 한다.
유방암 환자에게 수술 전 항암화학요법인 'AC요법'에 뒤따르는 4주기 'Taxoere(도세탁셀무수물)'과 비교해 'AC요법'에 뒤따르는 4주기 '나녹셀엠주' 치료의 유효성과 안전성을 비교 평가한다.
삼양바이오팜 관계자는 히트뉴스와 통화에서 "용법·용량을 변경하기 위해 임상시험계획을 승인받게 됐다"고 했다. AC 항암요법은 (Doxorubicin-독소루비신, Cyclophosphamide-시클로포스파미드) 투여 후 도세탁셀무수물/파크리탁셀을 투여하는 치료요법으로 3주 간격으로 4회 투여를 기본으로 하고 있다.
국립암센터는 헬리코박터 파일로리(H.pylori) 제균 치료에서 맞춤치료와 기존치료를 비교 평가하는 임상 3상을 승인받았다. 위절제술의 과거력이 있는 환자 등 482명을 대상으로 진행한다.
임상시험용 의약품은 ▷테라싸이클린캅셀250밀리그람(염산테트라싸이클린, 종근당) ▷씨제이후라시닐정(메트로니다졸, 씨제이헬스케어) ▷에이씰린캡슐500밀리그램(아목시실린수화물, 보령제약) ▷데놀정(비스무트시트르산염칼륨, 녹십자) ▷클라릭정500밀리그램(클래리트로마이신,보령제약) ▷란스톤엘에프디티정30밀리그램(란소프라졸, 한국다케다제약) 등 6품목이다.
헬리코박터 파일로리 제균을 위한 기본 3제 요법은 clarithromycin 500 mg(클래리트로마이신), amoxicillin 1000 mg(아목시실린), PPI(Lansoprazole 30 mg, 란소프라졸 등)을 투여하는 요법이었다. 단, 클래리트로마이신에 대한 내성 여부가 중요하다. 내성이 있다면 소화성궤양용제 Bismuth 300mg(성분명 비스무스, 제품명 데놀정)를 포함한 PPI(Lansoprazole 30 mg, 란소프라졸), tetracycline 500 mg(테트라싸이클린), Metronidazole 500 mg(메트로니다졸) 4제 요법을 선택해야 한다.
연구진은 맞춤치료군(Bisumth 포함 4제 요법)과 기존치료군(기본 3제요법)에서의 헬리코박터 제균치료 대상자군의 성공률을 두고 유효성을 평가할 계획이다.
한국에자이의 간세포암 표적항암제 '렌비마'
면역항암제 '키트루다(펨브롤리주맙)'와 표적항암제 '렌비마(렌바티닙)' 병용으로 암 치료 유효성을 살펴보는 임상 3상이 또 승인됐다. 우리나라에만 9개의 병용 임상이 승인됐는데 이번에는 재발성 또는 전이성 두경부 편평세포암 환자를 대상으로 진행한다. 한국엠에스디는 지난 30일 이같은 병용 임상3상 계획을 승인받았다. 키트루다 단독 군과 효능도 비교한다.
한국엠에스디는 ▷진행성 간세포암종 환자에 대한 1차 요법을 시작으로 ▷진행성 흑색종 ▷이전에 치료받은 이력이 있는 특정 고형 종양 ▷전이성 비 편평세포 비소세포폐암 ▷치료 경험이 없으며 종양에서 종양 비율 점수가 1% 이상인 전이성 비소세포폐암에 대한 임상을 진행하고 있다.
게다가 ▷이전에 치료 이력이 있는 백금 기반 2제 화학요법 및 면역요법 후 질병 진행을 경험한 전이성 비소세포 폐암 ▷진행성 또는 재발성 자궁내막암 ▷시스플라틴 치료에 부적합하고 종앙에 PD-L1이 발현된 참가자와 PD-L1 발현 상태와 무관하게 백금제제가 포함된 어떠한 화학요법에도 부적합한 참가자를 대상으로 한 국소 진행성 또는 전이성 요로상피세포암 환자 대상 임상도 승인을 받아 진행 중이다.
9건 중 8건이 임상 3상으로, 특정 고형 종양 환자 대상 임상은 2상이다. 키트루다를 판매하는 MSD와 렌비마를 판매하는 에자이가 전 세계 다국가에서 진행하고 있다. 렌비마의 치료 암종을 늘리고, 키트루다와 병용으로 성공률을 높이기 위해 연구를 진행 중인 것으로 알려졌다.
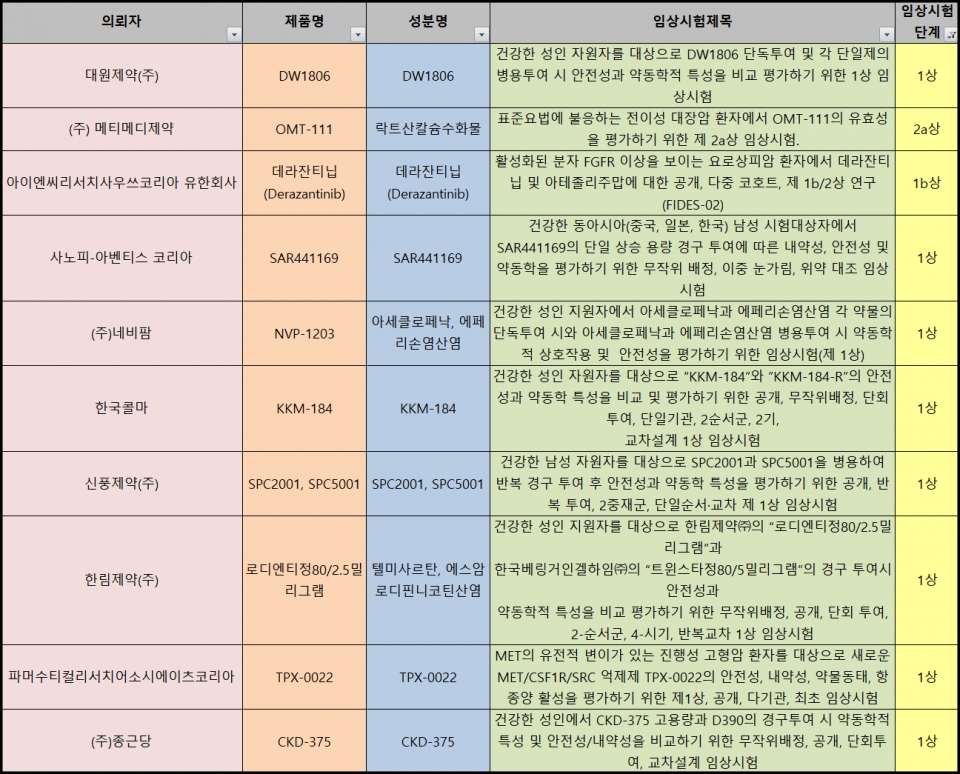
요로상피암 항암제 후보물질인 '데라잔티닙'과 면역항암제 '티센트릭(성분명 아테졸리주맙)'을 병용 투여하는 임상도 국내 승인됐다. 지난해 1월 데라잔티닙 라이선스를 가진 바실리아가 티센트릭을 개발한 로슈와 방광암 면역항암제 병용 임상시험 제휴를 체결한 후 국내에도 임상을 진행하게 된 것이다.

식약처는 활성화된 분자 FGFR 이상을 보이는 요로상피암 환자에서 데라잔티닙 및 아테졸리주맙에 대한 공개, 다중 코호트, 제 1b/2상 연구 (FIDES-02)를 지난 3일 승인했다. 데라잔티닙이 타깃으로 삼는 FGFR 키나제는 세포의 증식, 분화, 이동을 도우며 간·방광·유방·폐·위의 암에서 5~30% 변이된 것으로 전해졌다. 아울러 종양을 촉진하는 세포 수를 줄여 T세포 면역치료제의 반응을 높이는 것으로 기대받고 있다.
앞서 진행 중인 간내 담도암 환자 29명을 대상으로 한 임상 2상 중간 분석 데이터를 보면 데라잔티닙 치료의 객관적 반응률(ORR)은 21%로 나타났다. 6명은 부분 반응으로 질환 조절률(DCR) 84%를 보였다. 바질리아는 올해 중반기 2상 최종 자료가 나온다고 밝혔다.
바실리아는 2018년 미국 바이오제약기업 아큘로부터 데라잔티닙 라이선스를 확보했고, 지난해 중반부터 로슈의 '티센트릭'과 글로벌 병용 1b/2상 임상시험을 진행하고 있다.
관련기사
- 릴리 편두통 신약 '라스미디탄' FDA 승인 취득
- 일라이 릴리, 편두통치료제 '라스미디탄' 3상 중간결과 발표
- 릴리, 편두통치료제 라스미디탄 FDA 승인 신청
- 일동 3세 윤웅섭, 역동적 기업으로 그 출발점
- [허가/임상] 108품목 신규허가...고혈압약 여전히 선두
- 렌비마, 간세포성암 1차 치료에 전체 생존기간 연장 입증
- 간세포암 겉으론 ‘넥사바vs렌비마’…실속은 아바스틴?
- 대웅 SGLT-2, 환자군 확대… 삼진, '쇼그렌증후군' 도전
- 카보메틱스도 'next 넥사바'...답답하기만 한 렌비마
- "간세포성암, 1차서 반응률 높은 치료제 선택해야"
- 키트루다, 렌비마와 병용 임상 추진...간세포암 타깃
- 보령-표적항암제·씨제이-자가면역 신약 개발 도전
- '레이저티닙' 글로벌 3상 국내서도 착수… NASH 임상 잇달아
- 챔픽스 후속약물, 갱년기 페졸리네탄트 임상 승인
- 케이캡, 적응증 확대 임상… 일동 자회사, 항암신약 도전
- 종근당 대장암·제일 P-CAB 계열 신약개발 임상 박차
- 2주간 임상승인 40건 육박...일동, 치매 신약 3상
- 한림, 자가면역 신약 '류마티스' 넘어 '간 이식' 반응 확인
- 대웅, 보툴리눔 톡신 '나보타' 격차 벌인다…'사각턱' 개선 3상
- 일동, 편두통치료제 라스미디탄 가교임상 종료

