식약처, 업계-학계-의약사-환자-소비자 등 참여 민관협의체 구성

제네릭 의약품에 대한 허가 및 사후관리 체계 전반에 대한 개선논의가 이뤄진다.
식품의약품안전처가 내놓은 제네릭 허가제도 개선방안 중 하나였던 공동생동 규제가 백지화됨에 따라, 제네릭 난립을 막고 국제경쟁력을 제고할 수 있는 또다른 방안을 찾는 것으로 보인다.
식약처는 28일 업계와 학계, 의약사, 환자 등이 참여하는 민관협의체를 구성해 현재 제네릭 허가·심사 및 사후관리 전반에 대한 개선을 추진한다고 밝혔다.
현재 많은 제네릭이 위·수탁 등을 통해 생산 유통되고 있는 상황에서, 현재와 같은 허가·심사·사후관리체계로는 고품질의 제네릭 시장공급이 힘들 것이라는 판단이다.
또한 의약사·소비자에게 명확한 정보제공, 품목 허가·관리 합리적 효율성을 지속 제고시키기에도 한계가 있다는 의견이다.
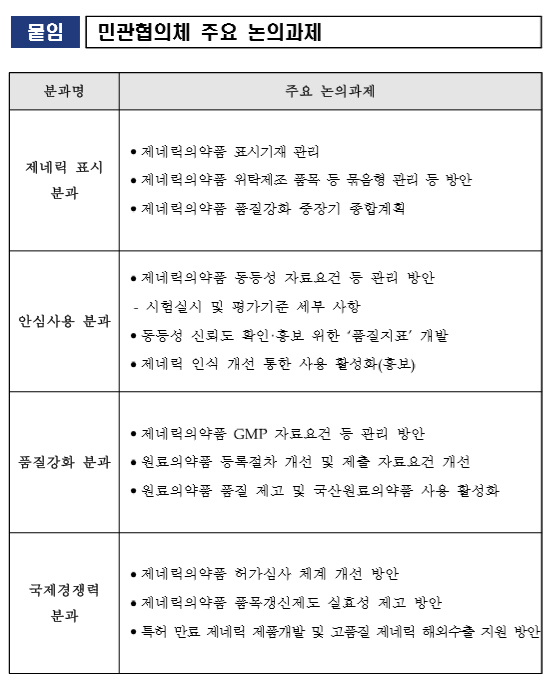
식약처는 '제네릭의약품 국제경쟁력 강화를 위한 민관협의체'를 구성해 약 2개월간 운영할 계획이며, 27일 1차 회의를 개최했다.
민관협의체는 제약업계, 학계, 의사, 약사, 환자, 소비자 단체들로 구성됐다.
주요 논의사항은 ▲제네릭의약품 품질강화 중장기 종합계획 ▲표시기재 개선 사항 ▲동일 제조소 제네릭의약품 ‘묶음형’ 관리 방안 ▲동등성 자료요건 등 허가심사 규정 개선사항 ▲GMP 등 품질개선 방안 ▲제네릭의약품에 대한 사용자·소비자 인식제고 방안 등이다.
식약처는 "앞으로도 민관협의체 운영 등을 통해 현장의 목소리를 청취해 실효성 있는 제네릭 관리정책을 마련할 것"이라며 "우리나라 'K-제네릭'의 국제경쟁력을 강화하는 정책을 지속적으로 추진해나갈 계획"이라고 강조했다.
관련기사
- N개 제네릭 공동생동 해도, 등재신청 20번째 안에들면 'OK'
- 공동생동 제한 철회됐지만 '제네릭 레드카드' 살아있다
- "사라진 공동생동 1+3"… 수탁사 '환영' · 영향력 '의문'
- "공동생동 제한, 2010년 폐지 규제와 비슷, 재도입사유 없다"
- "대책없는 제네릭의약품 난립, 언제까지 방치하나"
- '위탁 제네릭 3배치 생산 의무화' 허가 규제도 철회될까
- 공동생동의 다른말 '묶음형'? 식약처, 허가·관리기준 마련
- 브리핑 | "희망보다 신중" 렘데시비르, 결과 더 지켜봐야
- '묶음형' 제네릭 품질검사, 식품의약품안전평가원이 전담
- 묶음형 제네릭 허가보완은 '수탁사의 몫'…심사효율성 제고
- 의약품 개발에서 시판 후까지 ‘품목관리자’ 원스톱 지원
- 제네릭의약품 국제 경쟁력 강화 방안 6월말까지 결과 도출
- '제네릭 경쟁력 강화 민관협의체' 운영결과 이번주 발표

