이니바이오, 2020년 수출용 이니보주 허가…3년 만 국내 판매 허가
지엘팜텍 "3상 약 2년 소요 예상…단축 위해 아주약품과 최선 다할 것"
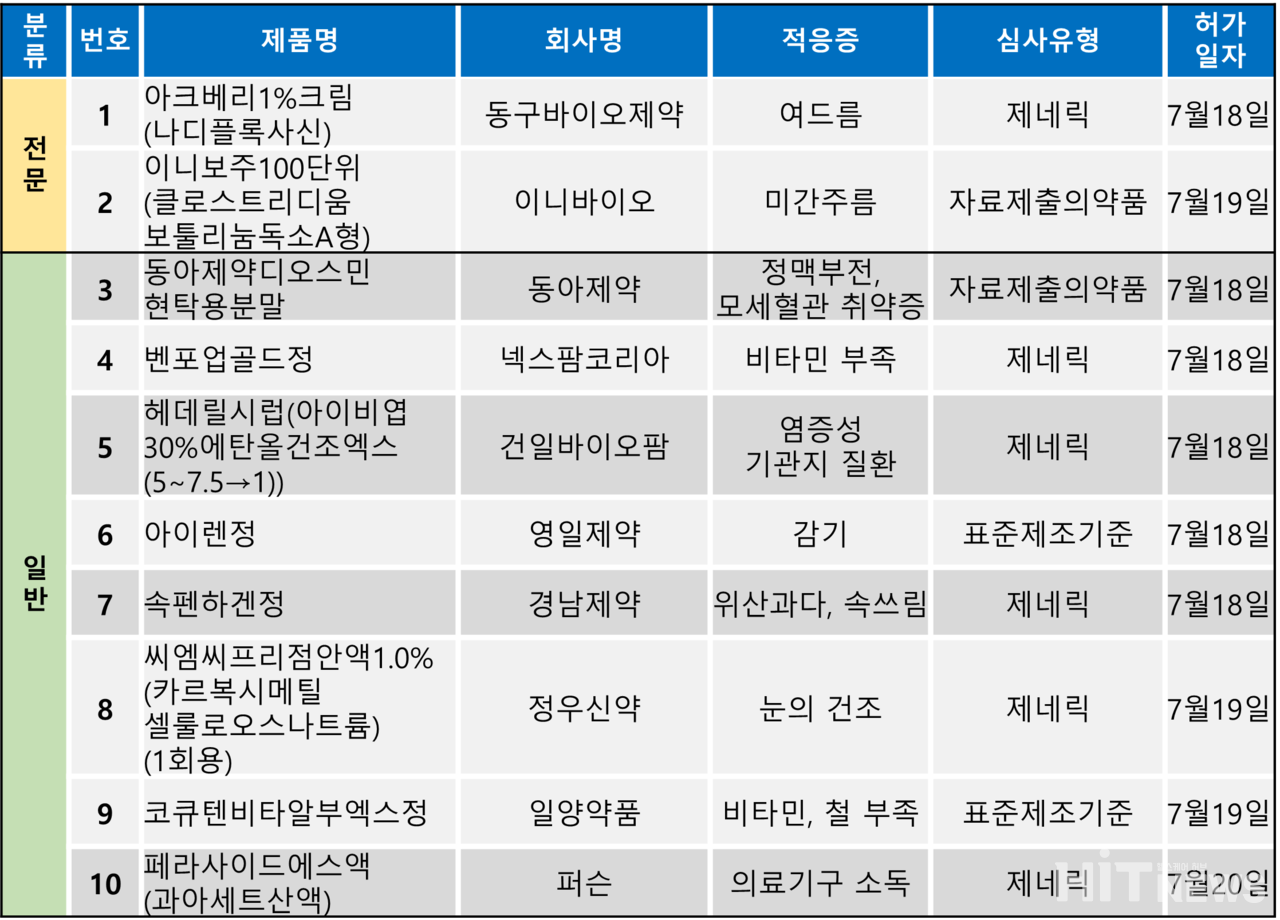
지난주(7월 17~21일) 총 10개 품목이 식품의약품안전처로부터 품목 허가를 받았다. 전문의약품은 2개 품목, 일반의약품은 8개 품목이었다. 허가 품목들은 미간주름, 여드름, 염증성 기관지 질환, 위산과다 등 다양한 적응증으로 허가됐다.
이니바이오가 개발한 보툴리눔 톡신 제제 ‘이니보주’가 국내 판매용으로 지난 19일 허가됐다. 회사는 해당 제품을 2020년 수출용으로 허가받은 바 있지만, 국내 판매용으로 허가받은 것은 이번이 처음이다.
식약처는 이니바이오의 이니보주를 '성인의 눈썹주름근(Corrugator muscle), 눈살근(Procerus muscle) 활동 관련 미간 주름의 일시적 개선'을 목적으로 사용할 수 있도록 허가했다.
현재 국내 내수용으로 허가된 보툴리눔 톡신 제제는 이니보주를 제외하고 △한국애브비 '보톡스주' △멀츠 '제오민주' △대웅제약 '나보타주' △휴젤 '보툴렉스주' △휴온스바이오파마 '리즈톡스' △휴메딕스 '비비톡신주' △메디톡스 '메디톡신', '이노톡스', '코어톡스' △대웅바이오 '에이톡신주' △종근당 '원더톡스주' △입센바이오 '디스포트주' 등이 있다.
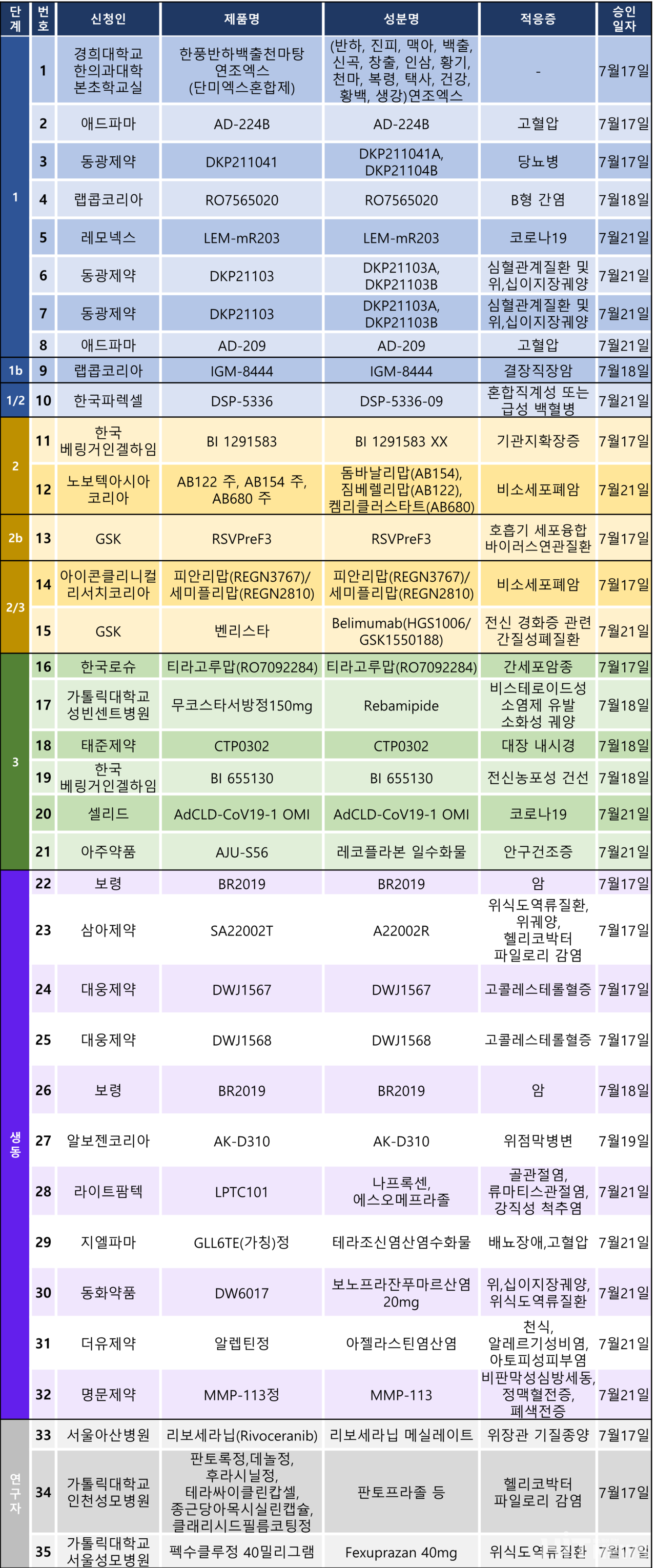
임상시험계획은 총 35건이 승인됐다. 세부적으로 △1상 8건 △1b상 1건 △1/2상 1건 △2상 2건 △2b상 1건 △2/3상 2건 △3상 6건 △생물학적동등성 11건 △연구자 임상 3건 등이다. 이 임상시험들은 고혈압, 당뇨병, 고콜레스테롤혈증, 만성 B형 간염, 코로나19 바이러스 감염, 전신 농포성 건선, 안구건조증 등 질환과 비소세포폐암, 결장직장암, 간세포암 등 암종을 대상으로 승인됐다.
아주약품, 지엘팜텍, 오큐라바이오사이언스가 공동 개발 중인 안구건조증 치료 신약 후보물질 'GLH8NDE/AJU-S56(성분 레코플라본·Recoflavone)' 점안제의 3상 임상시험계획이 21일 승인됐다.
이번 임상 3상은 안구건조증 환자를 대상으로 AJU-S56 5%의 유효성 및 안전성을 평가하기 위한 다기관, 무작위 배정, 이중 눈가림, 평행, 위약 대조 우월성 입증 연구다. 연세대 의대 세브란스병원을 포함해 국내 32개 임상시험기관에서 진행된다.
연구진은 안구건조증 환자를 대상으로 위약 대비 유효성과 장기간 투약에 따른 안전성을 함께 평가할 계획이다. 시험 대상자는 임상시험용 의약품을 1일 4회씩 가능한 매일 일정한 시간에 4시간(±1시간) 간격으로 양안에 투여하게 된다.
연구의 1차 유효성 평가변수는 기저치 대비 12주 시점의 총각막염색지수(Total Corneal fluorescein Staining Scores·TCSS) 변화량이며, 2차 유효성 평가변수는 기저치 대비 4, 8주 시점의 TCSS 변화량 및 4, 8, 12주 포함 모든 방문 시점의 리사민 그린 염색 지수 점수(Lissamine Green Conjunctival staining Scores·LGCSS) 변화량 등이다.
지엘팜텍 측에 따르면, 이번 임상 3상 승인은 중등도 이상의 안구건조증 환자 103명을 대상으로 진행됐던 임상 2상의 '객관적 징후(sign)' 및 '주관적 증상(symptom)'의 유의미한 개선 효과 때문인 것으로 나타났다.
박준상 지엘팜텍 최고기술책임자(CTO)는 "GLH8NDE/AJU-S56은 항염증, 뮤신(mucin) 분비, 배상세포 회복력이 모두 효과적이었고, 이를 뒷받침하는 우수한 임상 2상 결과도 확보했다"며 "이번 임상 3상을 통해 새로운 안구건조증 치료제가 될 수 있을 것으로 기대된다"고 밝혔다.
박 CTO는 이어 "이번 임상에서 6개월 이상의 장기간 투약 안전성 평가로 인해 총 임상 기간이 2년 가까이 소요될 것으로 예상된다"면서도 "임상 기간 단축을 위해 공동 개발사인 아주약품과 함께 최선의 노력을 다하겠다"고 덧붙였다.

