심평원 연구보고서, 선별등재 평가시 임상 처방경험 적어 한계
새로운 근거 축적 여부·치료과정 지위 변화 등 살펴봐야

급여적정성 재평가 대상이 '선별등재제도' 시행 후인 2007년 이후 등재된 의약품으로 확대될지 관심을 모은다.
선별등재제도(Positive List System)는 판매허가를 받은 의약품 중 임상적·경제적으로 가치가 높은 의약품을 선별해 '건강보험 급여대상'으로 적용하는 제도로, 2006년 12월 도입됐다. 이미 임상적 유용성과 비용 효과성 평가를 거쳐 급여등재된 만큼 제약업계에서는 달가워하지 않을 것으로 전망된다.
실제 시범사업 대상이었던 콜린알포세레이트 제제부터 지난달 공개된 티옥트산 등 2024년 급여적정성 재평가 대상 7개 성분은 1990년대에서 2006년까지, 선별등재제도 시행 이전에 등재된 성분이었다.
하지만 한국보건사회연구원 박실비아 연구위원 등 연구진은 건강보험심사평가원이 진행한 '약제 급여적정성 재평가 합리화 방안 연구'에서 2007년 이후 등재된 성분에 대한 임상적 유용성과 비용 효과성을 살펴볼 필요가 있다고 밝혔다.
연구진은 2007년부터 선별목록제가 시행되면서 새로운 약제는 임상적 유용성의 개선, 비용 효과성 등을 엄밀히 평가받은 후 등재됐지만, 등재 평가시에는 아직 임상 현장에서 의약품을 사용한 경험이 적어 임상적 유용성과 비용 효과성의 근거에 한계가 있다고 지적했다.
또 등재 후 임상에서 오래 사용되면서 처음 기대했던 정도의 효과가 나타나는지에 대한 근거가 새롭게 축적될 수 있고, 등재 이후 기술 발전 등에 따라 다른 대체가능한 약들이 개발되면서 약이 치료 과정에서 사용되던 지위가 달라졌을 수 있다고도 덧붙였다.
연구진은 "2007년 선별목록제 이후 보험약제 정책은 계속 변화의 과정을 거쳤는데, 2014년을 기점으로 신약 등재와 관련 제도의 큰 변화가 이뤄졌다. 2014년부터 위험분담제도가 시행됐고, 2015년에는 경제성평가 면제, 약가협상 생략을 통한 빠른 등재 방식이 마련됐다"면서 약제 급여적정성 재평가의 2기 사업은 2007~2013년 등재된 성분을 중심으로 계획해야 된다고 했다.
그러면서 대상 성분 3년 평균 청구액 0.1% 기준을 더 낮출 수 있으며, A8 국가 6국 미만 등재와 식약처 임상재평가 공고 성분 등 일부 변화된 기준을 제안했다. <관련기사: "급여재평가, 청구기준 낮추고 임상재평가 약제 포함">
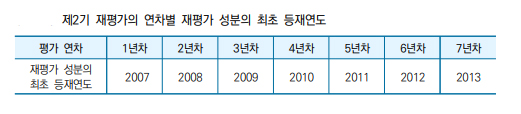
연구진은 "1년차에는 2007년 최초 등재 성분을 대상으로 하고, 매년 다음 등재연도의 성분을 대상으로 선정한다. 한 해에 한 연도의 최초 등재 성분을 재평가함으로써 재평가의 주기를 동일하게 적용할 수 있다. 2007년 이후 등재 성분은 아직 20년이 되지 않은 것으로, 임상적 유용성 등의 새로운 근거를 재평가하기 위해서는 동일한 시간 간격을 두는 것이 합리적"이라고 말했다.
이와 함께 연구진은 약제 급여적정성 재평가의 합리적인 운영 방안을 위해 재평가 향후 계획을 사전에 발표하고 △재평가 과정에서 제약사와의 소통을 강화 △재평가를 위한 위원회 개최시 충분한 논의가 이뤄질 수 있도록 평가 △결과를 제약사에 통보할 때 이유를 가급적 상세히 설명 △재평가 결과 급여 제외 또는 선별급여로 결정되는 경우 단계적 이행 가능 △재평가 결과를 사회 홍보할 것 등을 제안했다.

