코19 고위험군 환자 60명 대상으로 안전성·유효성 평가
가까운 시일 내 환자 투여… 회사 측 "국민 관심·참여 부탁"
식품의약품안전처(처장 이의경)은 GC녹십자의 코로나19 혈장분획치료제 'GC5131'의 2상 임상시험계획(IND)을 승인했다고 20일 밝혔다.
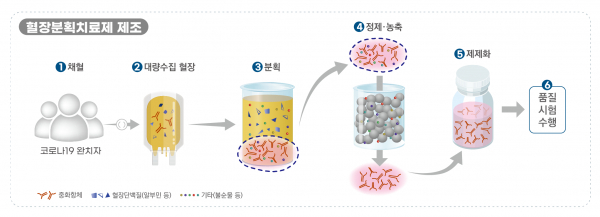
'GC5131'은 코로나19 완치자의 혈장을 대량으로 수집한 후 여러 공정을 거쳐 제품화한 것으로 코로나19 중화항체가 농축된 '고면역글로불린' 성분 의약품이다.
GC녹십자에 따르면, 약물재창출 연구 이외에 개발 중인 코로나19 치료제 중 임상 2상을 승인 받은 것은 이번이 처음이다. 이번 임상은 영상학적 진단으로 확인된 폐렴 환자와 고령 및 기저질환이 있는 고위험군 환자 60명을 대상으로 진행된다.
회사 측은 이미 임상시험용 제제 생산이 완료된 만큼, 가까운 시일 내 환자 투여가 개시될 것이라는 설명이다.
임상은 삼성서울병원, 서울아산병원, 중앙대병원, 고대안산병원, 충남대병원 등에 이어 연대 세브란스병원이 연구 참여 의사를 밝혀 총 6개의 병원에서 진행될 계획이다.
혈장치료제는 신종 감염병 발발 시 빠르게 투약 가능한 의약품으로 분류된다.
식약처는 GC5131의 원료물질인 혈장이 인체에서 유래하고, 중화항체를 이용해 질병을 치료하는 동일 원리를 적용한 제품이 예전부터 개발돼 사용되는 점에서 안전성을 평가하는 임상 1상 시험을 면제했다.
따라서 개발 과정도 간소화될 수 있다는 게 GC녹십자 설명이다.
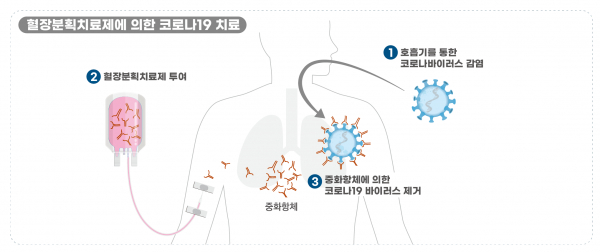
코로나19 바이러스가 호흡기를 통해 침입, 감염을 일으킬 때 혈장분획치료제에 농축된 항체가 바이러스를 제거하는 작용 기전을 갖고 있다.
해외에서도 프랑스, 중국, 일본 및 이탈리아에서 혈장분획치료제를 개발 중이며, 현재 6개의 소규모 임상시험이 진행 중에 있다.
현재 국내에서 코로나19 관련해 진행 중인 치료제 및 백신의 임상시험은 총 16건(치료제 14건, 백신 2건)이 됐다.
이에 대해 김진 GC녹십자 의학본부장은 "국민들의 자발적인 동참이 혈장치료제 개발의 원동력"이라며 "향후 의료현장에서 쓰일 치료제 생산을 위해 더욱 많은 관심과 참여를 부탁한다"고 말했다.
한편, GC녹십자는 이와 별도로 '코로나19 혈장치료제 개발 얼라이언스(CoVIg-19 Plasma Alliance)'에 합류해 다케다(Takeda), CSL Behring 등 글로벌 혈액제제 기업들과 해외용 혈장치료제 개발에도 참여하고 있다.
관련기사
- 코로나 약물 임상 1224건… 3월 대비 20배 증가
- 임상시험용 혈장치료제 제조 마쳐… "식약처 승인 시 임상 착수"
- GC녹십자, 코로나19 혈장치료제 임상 2상 신청
- 코로나19 국내 임상 15건… '클로로퀸' 임상은 중단
- GC녹십자, 코19 혈장치료제 전면 무상 공급키로
- 녹십자 대웅 신풍 SK 진원...코19 치료제백신 지원대상 후보에
- 위탁 제네릭 키우던 파모티딘, 대웅·콜마 '자체 생동' 가담
- 히트체크 | FDA 긴급승인 혈장치료법, 안전성 '확보' 효과는 '아직'
- '혈장치료'와 '혈장분획 치료제'는 다르다
- 코19 치료제·백신 개발 중… 제약사 임상 7건은 2상 단계
- GC녹십자, 코로나19 혈장치료제 국내 환자 첫 투여

