[Hit-Check] 2019년도 식약처 의약품 분야 규제영향 분석

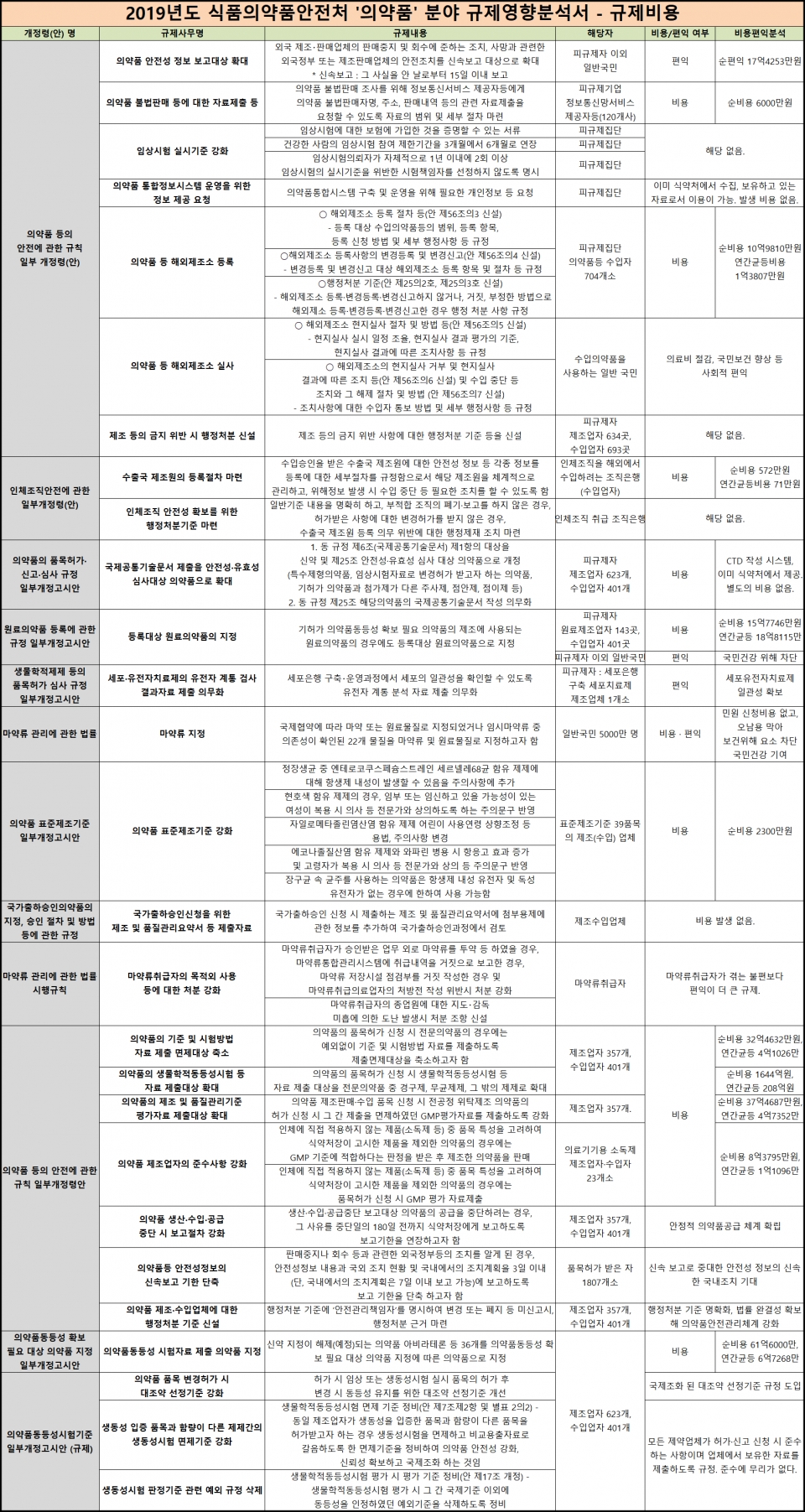
올해부터 2022년까지 모든 전문 의약품에 대해 단계별로 생동성시험을 진행하는 경우 제약업계가 부담해야할 비용은 1644억원에 이를 것으로 예상된다.
이 같은 예상은 지난해 식약처가 입법·행정예고를 하며 공개한 규제영향분석서를 결과에 따른 것으로 제약업계의 부담이 만만치 않은 상황이다.
식약처는 지난해 11월 발사르탄 불순물 검출에서 비롯된 제네릭의약품 안전관리 대책으로 원료의약품 등록(DMF) 대상부터 "모든 전문의약품은 생동성 시험 자료를 제출해야 한다"는 내용이 포함된 '의약품 등의 안전에 관한 규칙 일부개정령안'을 입법예고했었다.
생동성시험 자료 제출 대상이 모든 전문의약품으로 확대되고, 기준및 시험방법 자료역시 예외 없다는 내용이 포함돼 있다. 생산을 외부에 맡긴 위탁사도 GMP 평가자료를 내야한다.
▶모든 전문약, 생동성시험 해야=현재 전문약 중 정제, 캡슐제 또는 좌제와 의약품 동등성확보가 필요하다고 지정된 의약품만 생동성시험 자료를 내도 됐다. 전문약의 60%가 이에 해당한다. 하지만 올해부터 경구용 제제, 2021년 주사제를 포함한 무균제제, 2022년에는 기타·성분 제형이 모두 생동성시험 자료 제출 대상이 된다. 모든 제형으로 확대된 것이다.
당시 식약처는 "이 규정을 올해 6월에는 개정공포할 예정이며 공포 후 3년 간 단계적으로 시행할 계획"이라며 "품목허가 신청 요건 중 제네릭 위주로 선택적 규제를 강화하게 됐다. 의약품 사전 안전관리로 무분별한 허가신청을 막고 의약품 품질 수준을 높일 수 있을 것"이라고 했다.

식약처는 모든 전문약을 생동성시험 하게 될 경우 비용편익 분석으로 제약업계가 1644억 원을 추가적으로 쓰게 된다고 내다봤다. 자체조사 한 비용을 토대로 기업은 생동성시험 한 건에 2억2000만원을 쓰고, 평균 92품목을 허가받을 것을 상정한 추정치다.
여기에 이화학적동등성시험 소요 비용과 시험 소요 시간, 인건비와 건수, 심사 수수료를 산정했다. 그 결과 의약품 제조·수입업자들(제약업계)은(는) 품목허가 신청에 '1644억 원의' 행정부담이 든다는 의미다. 이를 제약업계가 10년 간 균등히 부담한다면 207억 원이 소요된다.
식약처는 분석서 결론부에 "일반 국민들을 위한 전문의약품 품질 강화 측면에서 보면 의료비 절감, 국민보건 향상, 안전성 확립 등 사회적 편익이 발생한다"며 "업체도 무분별한 의약품 품목허가(신고)를 억제해 제조판매 및 수입을 위한 선택과 집중에 나서 제조 및 품질관리를 보다 철저히 하며 제조공정을 개선할 것"이라고 했다.
식약처 관계자는 "규제비용 산출은 일종의 규제로 인한 활성화 비용이다. 업체 입장에선 써야하는 돈이 늘어난다 볼 수 있지만 이는 업체의 인건비, 장비비 등 제약산업의 활성화와 일자리를 창출할 수 있는 기회"라고 했다.
이 관계자는 "단기적으로 제약업계에 부담이지만, 결국 의약품 안전관리 체계를 만들 수 있다. 사회적 이익을 제약업계가 돌려받을 수 있다. 부담으로서 느끼기보다 업체별 대응책과 제네릭 난립을 막는 데 동조해달라"고 덧붙였다.
한편, 히트뉴스가 집계한 지난해 식약처의 12개 의약품 분야 규제영향분석서 주요 내용과 비용편익분석은 아래 그림, 첨부 파일과 같다.