전문약 허가 26개 품목 중 23개 품목 제2형당뇨병 치료제
셀트리온, 기존 '네시나메트정' 서방형으로 제형 변경한 품목 허가
보령, '듀카로'+'아토젯' 4제 복합제 병용투여 임상 3상 승인
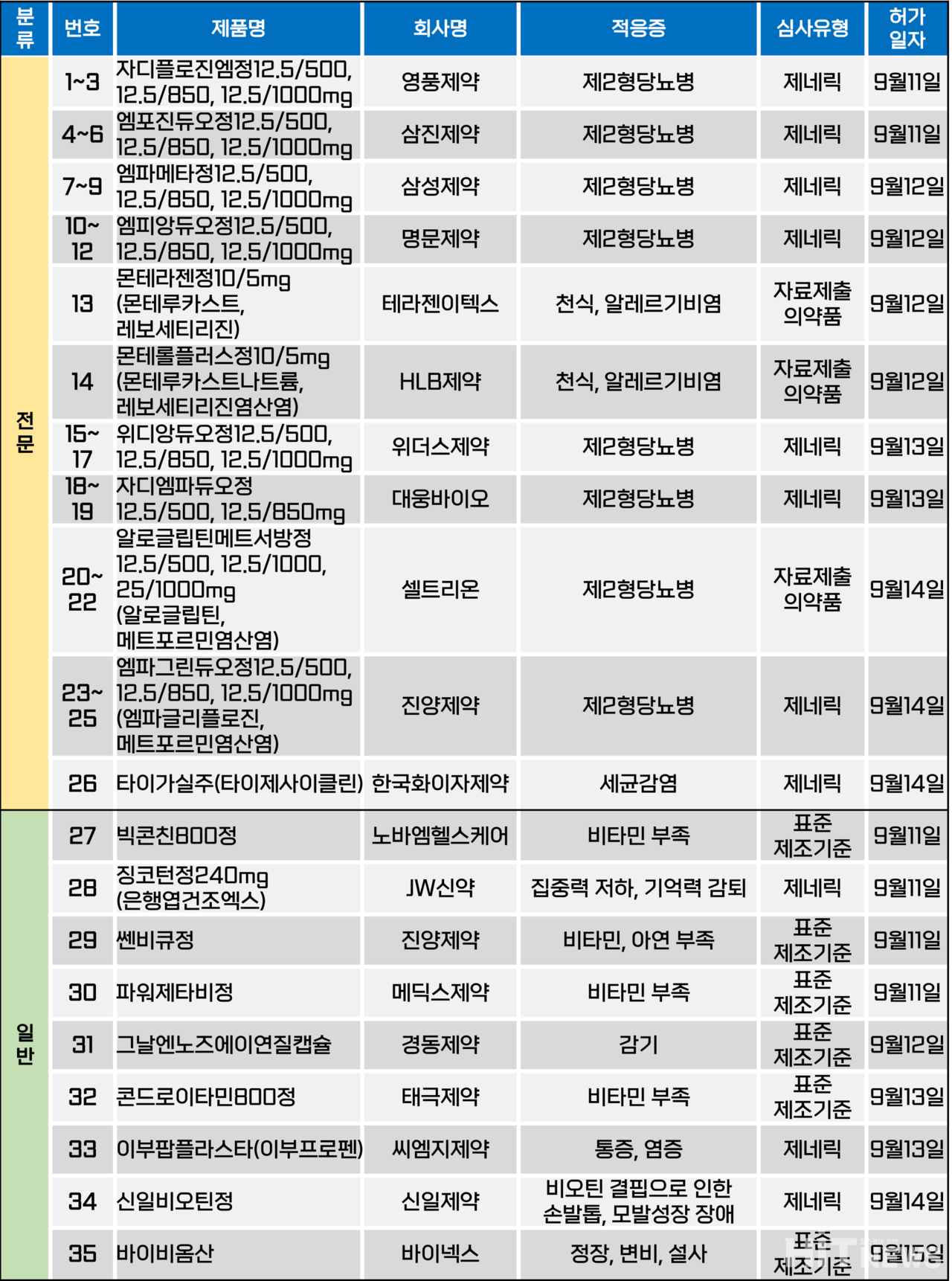
지난주(9월 11일~15일) 총 35개 품목이 식품의약품안전처로부터 품목 허가를 받았다. 전문의약품은 26개 품목, 일반의약품은 9개 품목이었다. 제2형 당뇨병, 천식, 알레르기성 비염, 세균 감염 등 다양한 적응증으로 허가됐다.
이 중 제2형 당뇨병을 적응증으로 가지는 품목은 23개로, 과반을 차지했다. 세부적으로 '엠파글리플로진+메트포르민' 복합제가 20개 품목, '알로글립틴+메트포르민' 복합제가 3개 품목이었다.
셀트리온은 기존 알로글립틴+메트포르민 제제의 제형을 서방형으로 변경한 제2형당뇨병 치료제 '알로글립틴메트서방정(성분 알로글립틴+메트포르민)'을 지난 14일 허가받았다. 국내에 알로글립틴 성분 당뇨병 치료제를 보유한 업체는 셀트리온제약뿐이다. 셀트리온그룹은 알로글립틴 오리지널 제제인 '네시나정(성분 알로글립틴)'의 국내 판권을 일본 다케다제약으로부터 가져온 바 있다.
이미 셀트리온제약은 알로글립틴과 메트포르민 복합제인 '네시나메트정'을 보유하고 있다. 다만 이번 허가는 기존 제제를 서방형으로 변경시킨 품목으로, 허가 용량 또한 △12.5/500㎎(알로글립틴/메트포르민) △12.5/850㎎ △12.5/1000㎎ 등 3개로 동일하다. 이 외에도 네시나정 라인업으로 TZD 계열 성분인 피오글리타존과의 복합제 '네시나엑트정' 4개 용량을 보유하고 있다.
한편 이번 허가에서 주목해야 할 점은 기존 셀트리온제약이 아닌 셀트리온 측으로 허가를 냈다는 점이다. 이에 다가오는 셀트리온, 셀트리온헬스케어, 셀트리온제약 등의 3사 합병을 대비해 미리 셀트리온 측으로 허가권을 몰고 있는 것이 아니냐는 추측이 나오고 있다.
서정진 셀트리온그룹 회장은 지난달 24일 국내 기관투자자 및 일반투자자를 대상으로 열린 기업설명회(IR)에서 "1단계와 2단계인 '단계별 합병'을 통해 셀트리온과 셀트리온헬스케어, 셀트리온제약을 모두 합병할 예정"이라며 "통합된 그룹 자원을 자체 신약과 인수합병(M&A), 라이선스 인(L/I) 등에 집중해 규모 있는 투자를 집행하겠다"고 전한 바 있다.
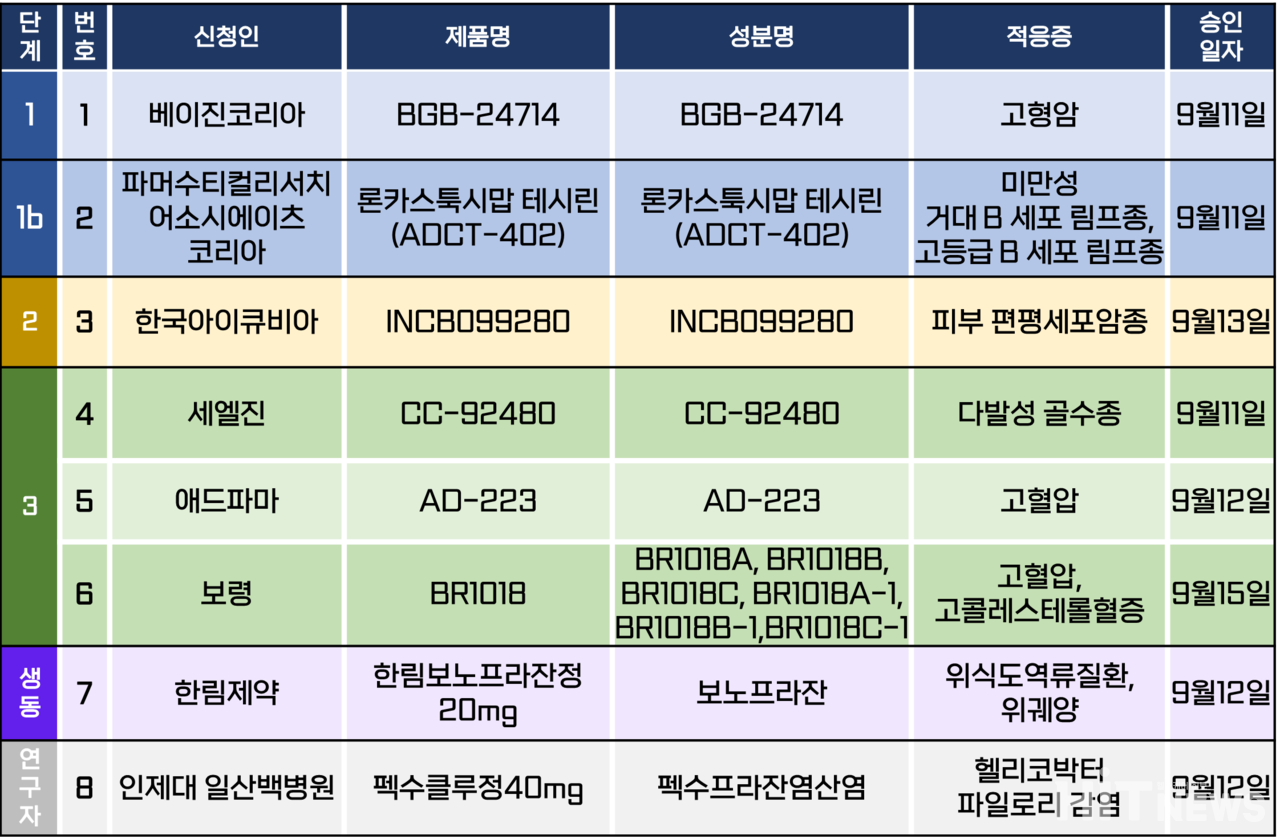
지난주 임상시험계획은 총 8건이 승인됐다. 세부적으로 △1상 1건 △1b상 1건 △2상 1건 △3상 3건 △생물학적동등성 1건 △연구자 임상 1건 등이다. 이 임상시험들은 고혈압, 고콜레스테롤혈증, 위식도 역류질환, 위쉐양, 헬리코박터 파일로리 감염 등 질환과 미만성 거대 B세포 림프종, 고등급 B세포 림프종, 피부 편평세포암종, 다발성 골수종 등 다양한 암종을 대상으로 승인됐다.
보령은 고혈압ㆍ고콜레스테롤혈증 4제 복합제를 개발하기 위한 3상 임상시험계획을 지난 15일 승인받았다고 공시를 통해 밝혔다. 회사가 지난 15일 공시한 내용에 따르면, 이번 임상 3상은 '본태성 고혈압과 원발성 고콜레스테롤혈증을 동반한 환자'를 대상으로 'BR1018B'와 'BR1018C' 병용 투여의 유효성 및 안전성을 비교 평가하기 위한 다기관, 무작위 배정, 이중 눈가림, 활성대조 연구다.
각 임상 의약품은 보령이 개발한 오리지널 고혈압 치료제인 '카나브(성분 피마사르탄)' 60㎎ 제제와 암로디핀 성분 간 복합제 '듀카로정' 및 고콜레스테롤혈증 치료제로 사용되는 에제티미브+아토르바스타틴 복합제인 것으로 추측된다.
회사 측은 이번 임상은 156명 모집을 목표로, 약 24개월(2025년 8월까지) 동안 진행할 예정이다. 이어 임상 결과를 추후 고혈압ㆍ고콜레스테롤혈증 4제 복합제 허가에 활용할 것이라고 설명했다.
한편 현재 국내에 허가된 고혈압ㆍ고지혈증 4제 복합제는 △한미약품 '아모잘탄엑스큐' △GC녹십자 '로제텔핀(성분 텔미사르탄+에제티미브+암로디핀+로수바스타틴)' △종근당 '누보로젯(성분 텔미사르탄+에제티미브+S-암로디핀+로수바스타틴)' △유한양행 '듀오웰에이플러스(성분 텔미사르탄+에제티미브+암로디핀+로수바스타틴)' △제일약품 '텔미칸큐(성분 텔미사르탄+에제티미브+암로디핀+로수바스타틴)' 등 5개 품목이 있다.
관련기사
- [HIT알공] 보령, 카나브 4제 복합제 국내 임상 3상 승인
- 한미약품, 고혈압·고지혈증 4제 복합제 시장서 독주 이어간다
- [허가/임상] 이중특이항체, 외투세포림프종 대상 3상 승인
- 셀트리온제약, 2분기 매출 1102억…"분기 사상 최대 실적"
- 의사에서 작가로…보령의사수필문학상 원고 공모 진행
- [허가/임상] 추석 연휴로 임상계획 0건 승인…허가 4건 중 전문약 단 1품목
- 커도 너무 큰 고혈압약? '텔미트렌' 36%나 줄였다
- '잘하는 걸 잘하게' 했더니… 보령, 올해 매출 8500억 넘보나
- Exceeding Expectations: Boryung’s Sales Surge to $626mn

