의약품 허가 규정과 동등성 고시·WHO 가이드라인 조화 추진
상반기 내 가이드라인 및 질의응답집 개정 예정
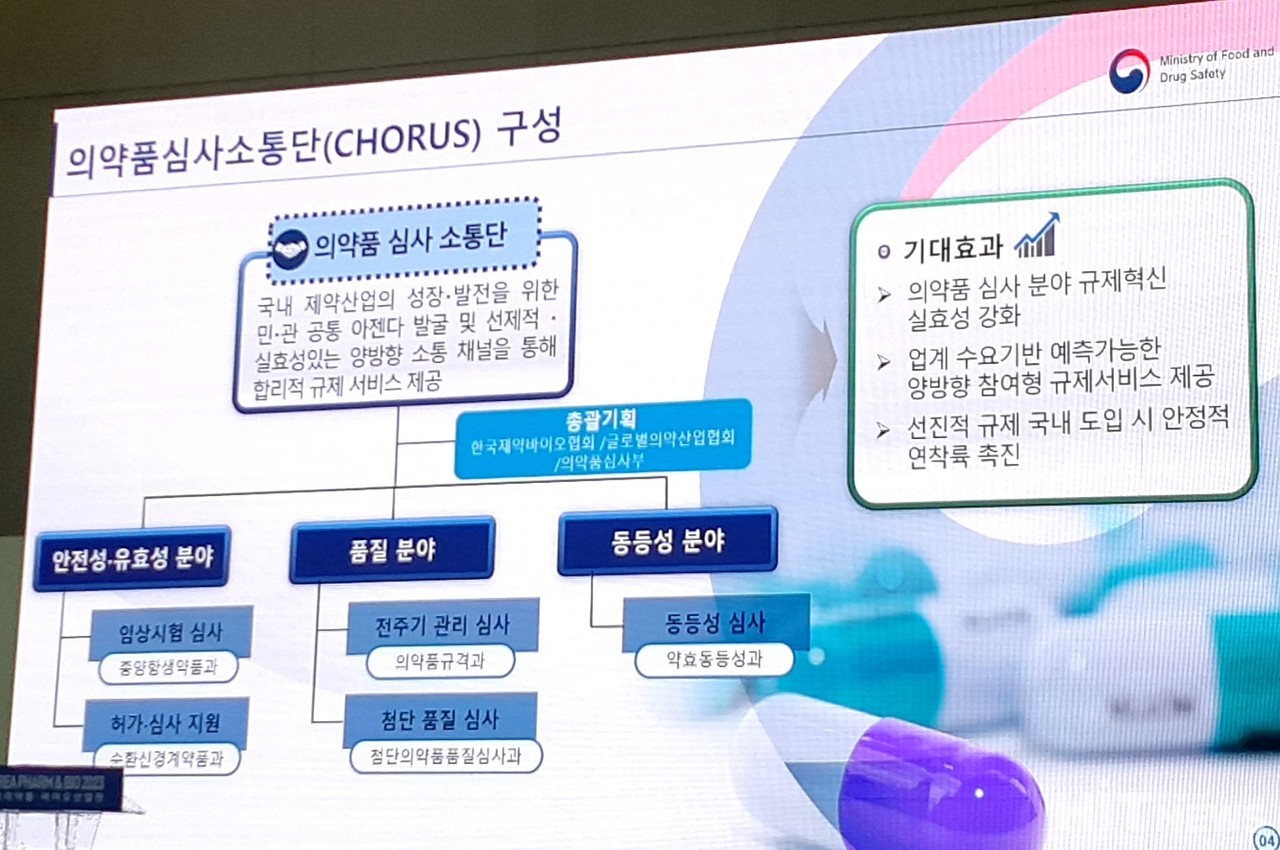
제약업계 실무진과 완전 소통을 목표로 출범한 식품의약품안전처 코러스(CHORUS) 내 '전주기 관리 심사' 분과의 첫 어젠다는 '허가 후 제조방법 변경관리 제도 개선'이 될 것으로 전망된다.
지난달 출범한 코러스는 식약처 심사관, 국내 제약사, 다국적 제약사, 의료기관, 협회 등 다양한 구성원들이 △임상시험 심사 △허가·심사 지원 △전주기 관리 심사 △첨단품질 심사 △동등성 심사 분야 등 각 분과와 관련된 사항을 논의하는 의약품 심사소통단이다.
히트뉴스는 지난 3월 30일 약효동등성과에서 ①비교용출시험 유사성 인자 적용 시 통계 방법 고려사항 ②이화학적 동등성시험 가이드라인 개정안 마련 ③생물약제학적 분류체계(BCS)에 따른 생동 시험 면제 ④의약품 동등성 재평가 가이드라인 발행 우선순위 등을 어젠다로 논의를 진행하고 있다고 밝힌 바 있다. 이번에 또 다른 분과 중 하나인 '전주기 관리 심사' 분과 역시 최근 어젠다를 구체화해 제도 반영을 추진 중인 것으로 나타났다.
김미정 식품의약품안전평가원 의약품규격과장은 25일 히트뉴스와 통화에서 "우리 분과가 주요 이슈로 다루고 있는 부분은 '허가 후 제조방법 변경관리'"라고 밝혔다. 허가 후 제조방법 변경관리 제도는 의약품 제법을 요약표로 기재하고, 원료의약품 제조원, 완제의약품 제조원, 제조공정 명칭 및 순서를 따로 기재하던 방식을 국제공통기술문서(CTD) 기반으로 작성하는 것으로 변경해 관리하기 위해 작년 11월부터 시행된 제도다.
김미정 과장은 "현재 허가 후 제조방법 변경관리는 제조업무에 한정돼 시행되고 있다"며 "작년부터 전주기 관리로 확대하기 위해 업계와 소통해 나가고 있다"고 말했다. 그는 이어 "전주기 관리 심사 분과에서는 약 6개월간 서류를 받아 심사해 오면서 우리가 그동안 겪은 시행착오 등 생각하지 못했던 문제점을 발굴해 개선하고, 고시 및 질의응답집을 개정하며, 향후 CTD 품질 자료로 범위를 확대하는 것들을 주로 논의하고 있다"고 설명했다.

추진 내용은 지난 21일 일산 킨텍스에서 진행된 '2023년 상반기 의약품 심사설명회'와 유사할 것으로 전망된다. 당시 식약처 의약품규격과 관계자는 "올해 10월 15일부터 CTD 작성 대상이 전문의약품 전체로 확대됨에 따라 CTD 품질자료 전체 항목의 허가 관리 및 변경관리를 추진해 나갈 것"이라고 설명한 바 있다.
김 과장은 "추진 내용을 구체적으로 살펴보면, 의약품 동등성시험 고시와 허가 규정 중 일치하지 않는 부분, 세계보건기구(WHO) 변경관리 가이드라인과 조화되지 않는 부분을 개선하려고 한다"면서 "우리나라가 현재 제조업무만 변경관리하고 있어서 생긴 문제로 파악되며, 외국과의 규제 간극을 좁혀나가기 위해 논의를 이어 나갈 것"이라고 말했다. 아울러 "이 사항들은 해외에 진출하려는 업체, 국내에 약을 들여오는 다국적사 등 다양한 업계 관계자들이 지적해 부분"이라고 덧붙였다.
한편 코러스 '전주기 관리' 분과는 내부에 △완제 △원료 △질의응답 △고시개정 등 4개의 작업반으로 분류해 운영되고 있다. 현재까지 총 2회 회의를 진행했으며, 오는 5월말 3차 회의를 앞두고 있는 것으로 확인됐다. 각 작업반은 업계에서 도출한 개정안들에 대한 논의를 진행할 예정이다. 추후 식약처 검토가 완료되면, 오는 6월 중 제조방법 변경관리 가이드라인과 관련 질의응답집을 개정할 예정이다.
관련기사
- 코러스 동등성분과 키워드는 ①유사성인자 ②BCS ③재평가
- 기업과 식약처 양방향 의약품심사소통단 코러스 출범
- "식약처-제약계 실무진 나와"... 논의의 장 'CHORUS' 출범
- 식품의약품평가원 5개 부서, 핵심 심사정책 '대방출'
- 내부고발 유도하는 식약처, '왜왜분석'은 왜 안하나
- 코러스 첫 성과...'대조약 부재 시 해결방안' 등 가이드라인 개정
- 식약처 '코러스' 2번째 성과물, '비교용출시험 가이드라인' 개정
- 의약품 동등성 가이드라인 개정, 시험·대조약 '염' 달라도 생동 면제
- 취임 100일 박윤주 안전평가원장 "우린, 업계 규제 동반자"
- "내 의견이 지침에 반영된다"… 민관협의체 찾는 제약바이오 기업들

