1일 존슨앤드존슨, 엑손20 삽입 변이 폐암 1차 치료 최종 승인 발표
'리브리반트+화학요법', PFS 11.4개월로 대조군 6.7개월 대비 약 2배
업계, 한국얀센 '마리포사-1,2' 연구 결과도 함께 허가 추진할지 주목
최근 얀센이 개발한 '리브리반트(성분 아미반타맙)와 항암화학요법(카보플라틴+페메트렉시드) 병용요법'이 미국 식품의약국(FDA)으로부터 EGFR 엑손 20 삽입 변이 비소세포폐암 환자의 1차 치료제로 최종 승인됨에 따라 국내에서도 이에 대한 허가 절차가 본격 추진될 것으로 전망된다.
얀센의 모회사인 존슨앤드존슨(Johnson & Johnson)은 FDA로부터 리브리반트와 항암화학요법 병용요법이 EGFR 엑손 20 삽입 변이가 있는 국소 진행성ㆍ전이성 비소세포폐암 환자의 1차 치료제로 최종 승인됐다고 공식 입장을 지난 1일(현지 시각) 발표했다. 이번 허가는 지난 2021년 5월 신속 허가(accelerated approval) 절차를 거친 바 있던 리브리반트 병용요법이 글로벌 3상 연구인 '빠삐용(Papillon)' 임상 데이터를 기반으로 정식 허가로 전환된 것이다.
이번 FDA 허가가 완료됨에 따라 한국얀센도 본격적인 국내 허가 절차를 준비하고 있다는 업계 의견이 제기됐다. 5일 제약업계에 따르면, 얀센은 식품의약품안전처에 적응증 확대를 위한 변경허가 신청을 준비하고 있는 것으로 나타났다. 통상 변경허가는 최초 신약 허가에 비해 심사 기간이 적게 소요되는 만큼 얀센의 변경허가의 경우 별도의 심사 보완이 없는 한 올해 하반기나 늦어도 내년 초 중 완료되지 않겠냐는 게 업계 의견이다.
또 유한양행과 공동 개발 중인 비소세포폐암 치료제 '렉라자(성분 레이저티닙)'와 리브리반트 병용 임상을 연구한 '마리포사-1(MARIPOSA-1)', '마리포사-2' 데이터를 활용한 적응증 확대도 이번에 함께 추진하지 않겠냐는 전망도 나오고 있다. 마리포사-1 연구는 EGFR 변이 비소세포폐암 환자 1차 치료에 있어 '렉라자+리브리반트' 병용군과 타그리소군, 렉라자군의 유효성 및 안전성을 비교한 임상이다. 마리포사-2 연구는 타그리소 치료에 실패한 환자의 2차 치료에 있어 '렉라자+리브리반트+항암화학요법' 병용군과 항암화학 단독요법을 비교한 임상이다.
한국얀센 측은 "우리 회사는 희귀폐암 표적치료제인 리브리반트의 환자 접근성을 개선할 수 있는 방법을 다방면으로 모색하고 있다"면서 "아직 허가 절차와 관련된 부분은 언급하기 어려운 점 양해 바란다"고 전했다.
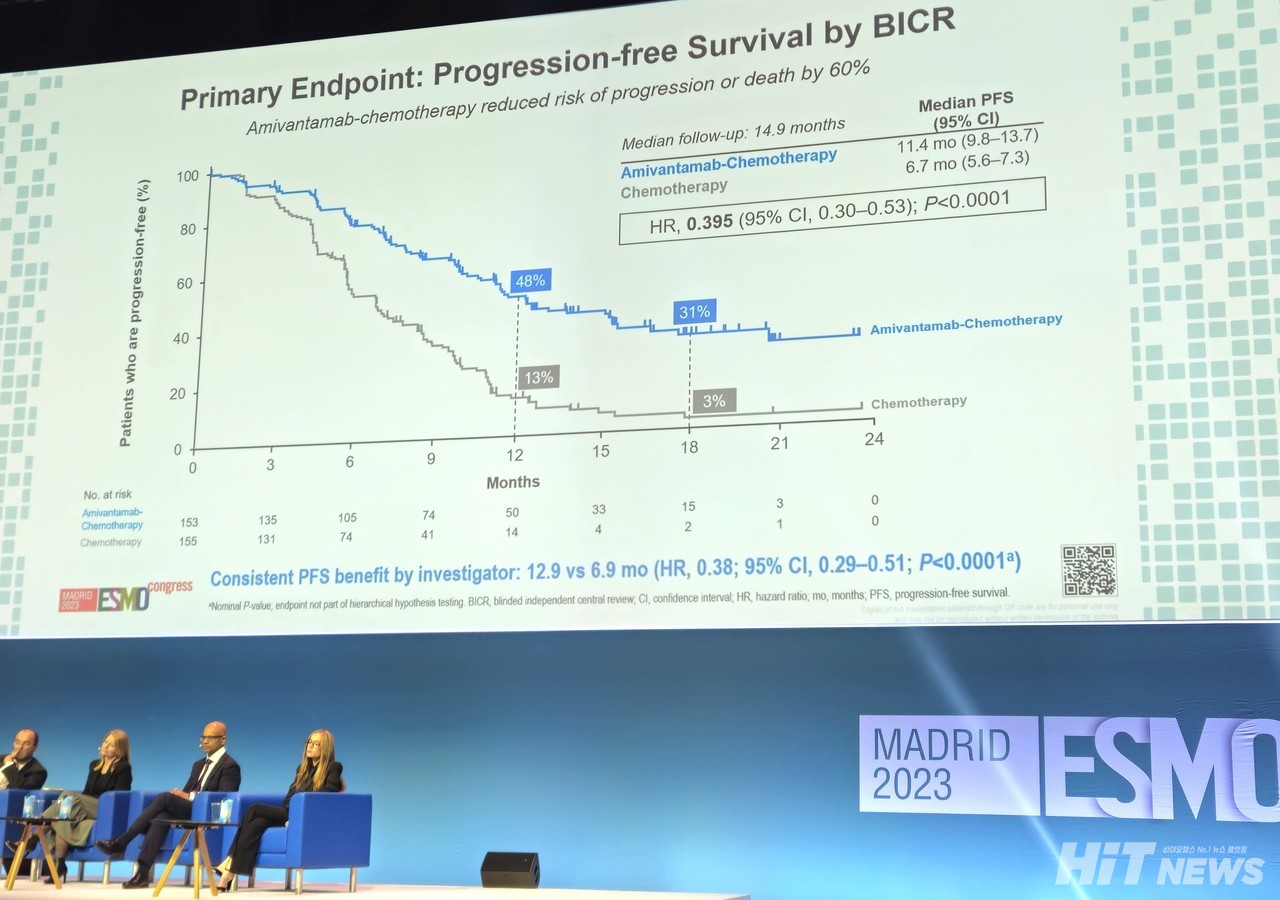
한편 빠삐용 3상 임상 결과는 작년 10월 스페인 마드리드에서 개최된 유럽종양학회(ESMO) 연례학술대회 프레지덴셜 세션(Presidential session)에서 공개된 바 있다. 'EGFR 엑손20 삽입 돌연변이 진행성 비소세포폐암(NSCLC)' 환자를 대상으로 한 이 연구는 리브리반트+항암화학요법군(병용요법군)과 항암화학 단독요법군의 유효성 및 안전성을 비교했다.

당시 발표를 맡은 니콜라스 지라드(Nicolas Girad) 베르사유 생 쿠엔틴대학 호흡기의학 교수에 따르면, 리브리반트 병용요법 1차 치료는 독립적 중앙 맹검 평가에 의한 무질병 생존기간(PFS by BICR), 반응기간(DOR by BICR), 객관적 반응률(ORR) 및 PFS2(1차 치료 중단 후 2차 치료의 무질병 생존기간)를 크게 개선했다.
세부적으로 살펴보면, 14.9개월의 중앙 추적 관찰 시점에 리브리반트 병용군의 PFS 중앙값은 11.4개월로(95% CI : 9.8-13.7), 항암화학 단독요법군 6.7개월(95% CI : 5.6-7.3)에 비해 2배 가까운 개선을 보였다. 또 질병 또는 사망에 대한 위험은 60.50% 감소한 것으로 나타났다(HR =0.395, 95% CI : 0.30–0.53, P<0.0001).
동일 시점에서 리브리반트 병용군의 ORR은 73%(95% CI : 65-80)로, 단독군 47%(95% CI : 39-56) 대비 개선을 보였다(Odd ratio=3, 95% CI : 1.8-4.8, P<0.0001). 반응기간 중앙값은 병용군 9.7개월(95% CI : 8.2-12.5), 단독군 4.4개월(95% CI : 4.1-5.6)로 나타났다. 당시 병용군은 2차 PFS 중앙값에 도달하지 못한 것으로 나타났고(NE, 95% CI : 22.8-NE), 전체 생존률(OS) 또한 아직 데이터가 성숙하지 않은 것으로 나타났다(24.4개월, 95% CI : 22.1-NE).
리브리반트 병용군에서 가장 흔하게 발현한 이상반응(AE)은 호중구감소증, 발진, 마비, 빈혈, 저알부민혈증 등이었다. 다만 3등급 이상의 AE 발생 비율은 병용군이 75%로, 단독군 54%에 비해 높았다.
발표 후 진행된 토론에 토론자로 나선 벤자민 베세(Benjamin Besse) 프랑스 빌주이프 구스타브 루시 연구소 교수는 "이번 연구 결과에서 1차 유효성 평가변수인 PFS 위험을 60.5% 감소시킨 것은 상당히 주목할 만한 것"이라면서 "그동안 엑손 20 변이 비소세포폐암 환자에서 이 정도의 개선을 가져온 약제는 없었다"며 새로운 1차 치료 표준요법으로의 가능성을 시사했다.
실제로 이후 미국종합암네트워크(NCCN)는 빠삐용 데이터를 기반으로 리브리반트 병용요법을 EGFR 엑손20 삽입 변이 비소세포폐암 환자 1차 치료를 위한 '카테고리 1(Category 1)' 선호요법으로 권고했다.
관련기사
- [허가/임상] '렉라자+리브리반트' 이상반응 관리 강화 2상 승인
- 본업·자회사 성장 유한양행, 렉라자 앞세워 매출 '2조원' 도전
- 단독 | 타그리소-렉라자, 협상 타결...내년 1월 폐암 1차 급여 적용
- 렉라자 품은 J&J, '리브리반트+화학치료'로 우선 FDA 허가 신청
- "렉라자·리브리반트 병용, '전체생존기간' 입증되면 표준치료법 가능"
- 번데기서 나비로…'렉라자+리브리반트', EGFR 변이 폐암 1차 치료 가능성 열려
- "리브리반트 병용, EGFR 엑손20 변이 폐암 1차 표준 치료 전환 기대"
- 마드리드에 모인 임상 전문가들… 세계인 암학회 ESMO 2023 개막
- 유한양행, 美 AACR서 면역항암제 2종 비임상 결과 포스터 발표
- "15개 적응증 급여확대 어렵네" 키트루다, 또 재논의

