'임신중절의약품 안전관리방안' 자문 회의 후 후속 논의 없어
현대약품, 품목허가자료 제출 보완기간 연장요청
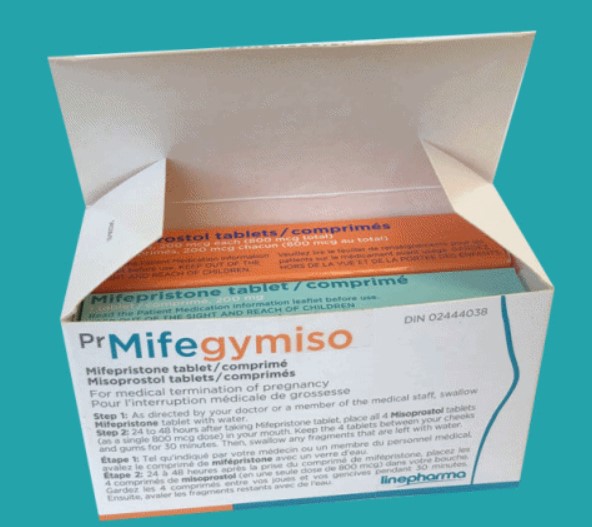
임신중절의약품인 현대약품 '미프지미소' 허가와 관련, 식품의약품안전처는 허가자료와 안전사용 계획 등을 검토 중이라고 입장을 밝히고 있지만, 품목허가 진행에 별다른 진전은 없는 상황이다.
미프지미소는 지난해 11월 열린 전문가단체 자문회의(산부인과의사회와 산부인과학회, 약사회 등)가 아무 결론 없이 종결된 이후 5개월째 후속 논의가 제대로 진행되지 않고 있다.
전문가 자문회의 당시 식품의약품안전처 문은희 과장은 "간담회에서는 미프지미소에 대해 ①산부인과에서만 처방을 하게 하느냐 ②그외 진료과목에서도 처방이 가능한 지 ③원내 처방만 또는 원내외 처방 여부 등에 대해 논의될 것"이라고 밝혔었다. 간담회에서 전문가 단체 간 입장 차이로 인해 식약처는 특별한 결론을 내지 못했던 것이다.
현대약품이 지난해 7월 식약처에 신청한 품목허가 절차도 자료 보완 등을 이유로 멈춰 있다. 회사는 해당 기간 내 자료 보완이 힘들다고 판단해 식약처에 보완 자료 제출 기한 연기를 요청한 상태다.
자료 보완 등을 요청된 경우에는 허가 심사 일정이 보완 완료 시까지 정지(Clock Stop)되기 때문에, 총 허가 심사 기간은 그만큼 더 길어지게 된다.
지난해 10월 국정감사에서 지적됐던 가교자료 면제와 관련된 사항도 해결되지 않았다. 가교임상은 해외 개발의약품이 국내로 들어올 경우, 한국인을 대상으로 동일한 안전성·유효성을 가지는 지 확인하는 시험이다. 가교임상이 진행될 경우, 품목허가가 2~3년 가량 지연될 수 있기 때문에 면제 여부를 두고 전문가 집단 간 논의가 필요함이 지적된 바 있다.
식약처 대변인실 관계자는 18일 전문언론 기자단과 인터뷰에서 "낙태죄 헌법불합치 결정 이후 임신중절의약품인 현대약품 '미프지미소정'이 허가 신청돼 심사가 진행 중이나, 심사 과정 중 일부 자료에 대한 보완이 필요해 업체에 보완 자료 제출 요청한 상태"라며 "안전성·유효성과 품질을 확인해 심사를 진행하면서 안전한 사용을 보장하기 위한 전문가용·환자용 교육자료, 시판 후 조사 등 안전사용 계획을 마련할 것"이라고 말했다.
가교자료 면제와 관련된 논의 진행 현황에 대해 식약처 관계자는 "국회에서 환자의 안전을 위해 관련 법령 개정 등이 선행되어야 함이 지적됐었던 것과 관련해 우리처는 가교자료 필요성 여부와 사용 범위 등을 포함해 업체에서 제출한 자료, 전 세계 사용현황, WHO 가이드라인 등을 종합적으로 검토 중에 있다"며 "법적으로 안정적인 환경에서 임신중절의약품을 사용할 수 있도록 법무부·복지부 등과 협력해서 국회의 법률 개정 절차를 적극 지원할 예정"이라고 밝혔다.
식약처는 이후 의약품 허가와 관련된 사항을 자문하는 '중앙약사심의위원회'의 구성원으로 다방면의 전문가 단체의 참여를 도모할 것이라는 입장이다. 과거 개최됐던 중앙약심에서도 산부인과 전문의가 위원으로 참석했고, 대한산부인과의사회도 참고인으로 참석해 의견을 제출했던 것으로 확인됐다.
한편, 현대약품은 지난해 3월 영국 제약사 라인파마 인터내셔널과 미프지미소의 국내 판권 및 독점 공급 계약을 체결해 동년 7월부터 국내 품목허가를 진행하고 있다.

