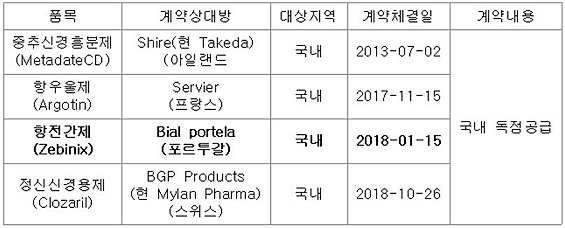
지난해 1월 비알社와 '제비닉스' 라이선스 계약 체결
WID-ESL18 임상1상 진행…발매 시점은 미지수

환인제약이 '제비닉스(Zebinix)'로 알려진 뇌전증 치료제의 국내 가교 임상시험에 착수했다.
식품의약품안전처는 환인제약이 신청한 'WID-ESL18'(에스리카바제핀 아세테이트)에 대한 임상시험계획서를 지난 3일 승인했다.
이 시험은 건강한 한국인 남성 30명과 코카시안(서양인) 남성 20명을 대상으로 서울대병원에서 진행되는 임상1상 시험이다.
환인제약은 WID-ESL18의 안전성 · 내약성과 약동학적 특성을 평가하기 위해 총 50명의 자원자를 대상으로 무작위 배정, 이중 눈가림, 위약 대조, 단회 · 반복 경구 투여, 용량 증량을 진행한다.
제비닉스는 포르투갈 비알(Bial) 사가 개발한 1일 1회 용법의 신약으로, 미국에서는 '압티옴(Aptiom)', 유럽에서는 제비닉스라는 이름으로 판매되고 있다. 유럽에서는 신규 성인 환자의 부분 발작에 대한 단독 요법과 성인 · 6세 이상 환자의 부가요법을 적응증으로 갖고 있다. 미국에서는 성인 · 4세 이상의 뇌전증 환자 치료에 사용된다.
이와 관련, 지난해 2월 환인제약은 비알 사와 제비닉스의 국내 독점 라이선스 계약을 체결했다. 당시 환인제약은 "품목허가를 신속히 진행해 기존 뇌전증 약물과 함께 새로운 치료 옵션을 제공할 것"이라고 기대했다.
현재 환인제약이 판매 중인 뇌전증 치료제는 프레가발린 성분의 '프리렙톨 캡슐 25mg · 75mg · 150mg · 300mg'과 지난 3월에 발매한 레비티라세탐 성분의 '케프렙톨 서방정500mg · 750mg'이 있다. 환인제약 관계자는 "'WID-ESL18'는 현재 임상1상 가교 시험을 진행 중이나 향후 발매 시점은 아직 미지수"라고 했다.
한편, 가교시험(Bridging Study)은 의약품의 안전성 · 유효성에 관한 민족적 요인에 차이가 있어 외국 임상자료를 그대로 적용할 수 없는 경우 한국인 대상 가교자료를 얻기 위해 시행하는 간략화된 임상시험이다.
*가교자료: 국내 · 외 거주 한국인 대상으로 얻어진 시험자료로, 임상시험자료집에서 발췌하거나 선별한 자료 또는 가교시험으로부터 얻어진 자료
가교시험은 인종적 요인이 미치는 영향을 적절하게 평가하고, 임상연구의 중복을 최소화해 신약을 신속하게 허가 · 공급할 수 있도록 1999년부터 국내에 도입됐다. 일례로 한국아스트라제네카의 고지혈증 치료제 '크레스토정'(로수바스타틴칼슘)은 아시아인과 코카시안 대상 가교시험에서 아시아인의 혈중 농도가 유의미하게 높게 나타나 용량이 10mg에서 5mg으로 조절된 바 있다.

