대원·알리코제약, '리나글립틴+메트포르민' 서방형 품목허가
HSG4112, 비만·심혈관 질환 치료제 개발 중… 2022년 대원제약에 L/O
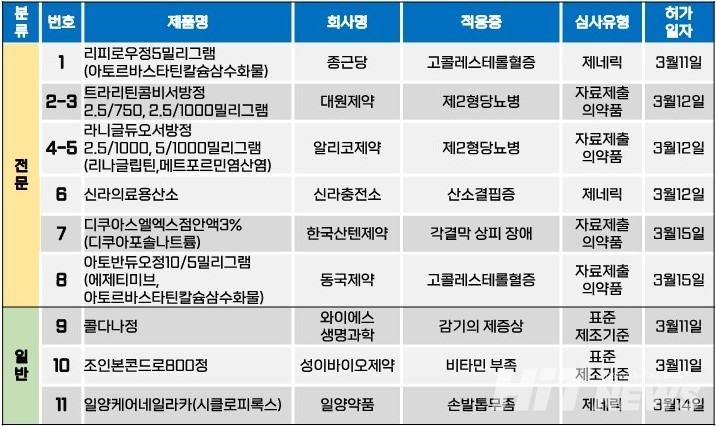
지난주(3월 11~15일) 총 11개 품목이 식품의약품안전처로부터 품목허가를 받았다. 전문의약품은 8개 품목, 일반의약품은 3개 품목이었다. 이 의약품들은 고콜레스테롤혈증, 제2형 당뇨병, 안구건조증으로 인한 각결막 상피 장애 등 다양한 적응증으로 허가됐다.
제2형 당뇨병 치료제로 사용되는 DPP-4 억제제인 '리나글립틴'과 '메트포르민' 성분의 서방형 복합제 4개 품목이 허가됐다. 식약처는 대원제약이 개발한 '트라리틴콤비서방정' 2.5/750㎎, 2.5/1000㎎(리나글립틴/메트포르민염산염 콜로이드성이산화규소)과 알리코제약이 개발한 '라니글듀오서방정' 2.5/1000㎎, 5/1000㎎ 등 4개 품목을 지난 12일 허가했다.
대원제약은 이미 작년 10월 13일 기존에 회사가 보유하고 있던 '트라리틴콤비정(성분 리나글립틴+메트포르민염산염)'의 염 및 제형 변경한 트라리틴콤비서방정 5/1000㎎에 대해 품목허가를 받은 바 있다.
알리코제약 역시 기존에 회사가 보유하고 있던 '라니글듀오정'의 서방형 제제로서 라니글듀오서방정에 대해 허가를 받았다. 다만, 기존 보유 품목들은 모두 리나글립틴을 2.5㎎ 함유하고 있었던 데 반해, 라니글듀오는 리나글립틴을 5㎎ 함유하고 있는 품목도 있다는 점에서 차이가 있다.
한편, 대원제약은 DPP-4 억제제 계열과 메트포르민 성분의 서방형 복합제 제품 중 처음으로 리나글립틴과 메트포르민을 조합으로 품목허가를 받은 업체다. 회사는 이번 허가로 △트라리틴(리나글립틴) △트라리틴콤비정 2.5/500㎎, 2.5/850㎎, 2.5/1000㎎ △트라리틴콤비서방정 2.5/750㎎, 2.5/1000㎎, 5/1000㎎ 등 총 7개의 리나글립틴 성분 품목군을 확보하게 됐다.
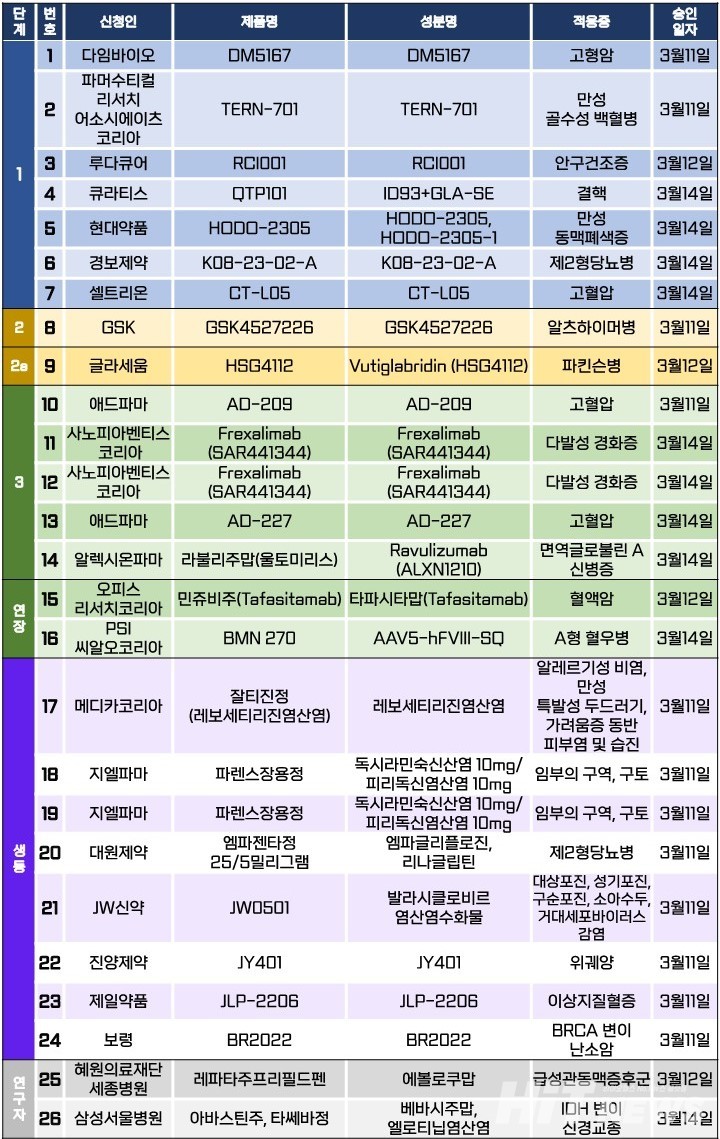
지난주 임상시험계획은 총 26건이 승인됐다. 세부적으로 △1상 7건 △2상 1건 △2a상 1건 △3상 5건 △연장 2건 △생물학적 동등성 8건 △연구자 임상 2건 등이다. 이 임상시험들은 고혈압, 안구건조증, 결핵, 만성 동맥폐쇄증, 제2형 당뇨병, 파킨슨병, 알츠하이머병, 다발성 경화증, 면역글로불린A 신병증 등 질환과 만성 골수성 백혈병, 난소암, 신경교종 등 암종을 대상으로 승인됐다.
글라세움이 개발 중인 비만 신약 후보물질인 'HSG4112(성분 부티글라브리딘∙Vutiglabridin)'의 파킨슨병 환자를 대상으로 한 2a상 임상시험계획(IND)이 지난 12일 승인됐다. 글라세움 측에 따르면, HSG4112는 비만을 비롯해 비알코올성 지방간염, 고지혈증, 고혈압 등 심혈관 질환의 예방 및 치료에 사용하기 위해 개발 중인 비마약성 물질이다. 감초의 성분인 '글라브리딘(glabridin)'의 화학구조를 변경한 물질로, 세포 내에서 'PON2 단백질'을 통해 미토콘드리아의 기능을 개선함으로써 활성산소를 제거하고 산화적 스트레스와 염증을 해소한다.
이번 임상 2a상은 초기 파킨슨병 환자에서 HSG4112의 유효성 및 안전성을 평가하기 위한 무작위 배정, 이중 눈가림, 위약 대조, 평행설계 연구다. 90명의 국내 환자를 참여시키는 것을 목표로, 2026년 3월까지 진행될 예정이다. 참여 의료기관은 △경희대병원 △가톨릭대 서울성모병원 △고려대 의대 부속 구로병원 △삼성서울병원 △연세대 세브란스병원 △인제대 상계백병원 등이다.
연구진은 환자군을 3개로 나눠 의약품을 투여한다. '시험군 1'은 식후 HSG4112 200㎎ 2정, 위약 2정이, '시험군 2'는 식후 HSG4112 200㎎ 4정이, '대조군'은 식후 위약이 4정 투여된다. 모든 환자군은 해당 용법에 따라 1일 1회 36주 반복 투여된다.
또, 연구진은 이번 임상의 1차 유효성 평가변수를 '베이스라인 대비 24주 시점의 군별 운동장애학회-통합 파킨슨병 평가 척도(MDS-UPDRS) part III 점수 변화량'으로 설정했다. 2차 유효성 평가변수는 베이스라인 대비 △4, 12, 28주 시점의 MDS-UPDRS part III 점수 변화량 △4, 12, 24, 28주 시점의 Clinician's Glbal Impression of Change (CGIC) 점수 변화 △12, 24주 시점의 K-NMSS(Korean-Non Motor Symptoms Scale) 점수 변화량 △파킨슨병 치료제 복용으로 인한 중도 탈락률 등이다.
한편, 글라세움은 현재 과체중 및 비만 환자를 대상으로 임상 2a상까지 마친 상태다. 임상 후 글라세움이 공개한 IR 자료에 따르면, 회사는 위고비+부티글라브리딘 병용 투여군에서 위고비 단독 투여군 대비 '체중 감소' 이점을 확인했다. 다만, '식욕 억제' 효과에서 시너지는 확인하지 못했다.
아울러 회사는 지난 2022년 5월 19일 대원제약에 'HSG4112'의 개발, 허가, 발매 등의 권한을 이전하는 라이선스 계약(L/O)을 체결한 바 있다. 이에 추후 비만 관련 임상은 대원제약 측에 의해 진행될 예정이다. L/O 계약 당시 백승열 대원제약 부회장은 "비만을 비롯해 각종 만성질환으로 장시간 고통받는 환자들에게 도움이 될 수 있는 혁신적인 치료제 개발에 최선을 다하겠다"고 밝힌 바 있다.

