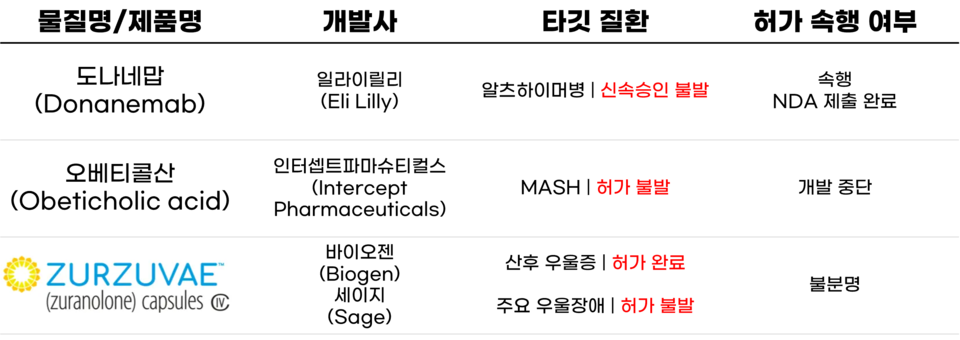
도나네맙, '약효 너무 빨라서' 신속승인 거절… 완전허가 목전
MASH 치료제 '이카로스' 오베티콜산… 인터셉트도 역사 뒤안길로
'반타작' 주르주베… 주요우울장애 치료제 허가 불발로 더 큰 시장 놓쳐

2024년의 첫 번째 주를 넘어가며 지난해를 돌아봅니다. 2023년 한 해 동안 미국 식품의약국(FDA)의 의약품평가연구센터(CDER)는 55개의 신약을, 생물의약품평가연구센터(CBER)는 17개의 신약을 허가했습니다. 2022년에 코로나19의 여파로 각각 37개ㆍ8개만을 허가했던 것에 비하면, 그 전년의 수준을 회복한 셈입니다.
이런 회복세 안에 주목할 만한 키워드들이 여럿 있습니다. 가장 큰 시장을 형성하고 있는 질환군인 '암'은 역시 올해도 빼놓을 수 없는 분야인데요. 그 중에서도 '이중항체' 기술이 적용된 신약 4개가 눈에 띕니다.
질환을 키워드로 조금 더 살피자면 'RSV(호흡기세포융합바이러스)' 감염증에 대한 최초의 백신이 작년에 탄생했습니다. '알츠하이머(Alzheimer's)' 분야에서는 지난 2021년에 이어 2번째 신약이 등장했고, 이젠 글로벌 메가 트렌드가 된 '비만' 치료제도 하나 더 나왔습니다.
회사를 중심으로 보자면 작년에 가장 많은 신약을 허가받은 '화이자(Pfizer)'가 주목할 만하고, 국가를 중심으로 보면 '중국과 일본'이 상당한 성과를 냈다는 것도 흥미로운 부분입니다. 그리고 모달리티(Modality)로 렌즈를 갈아끼워 보면, 최초의 크리스퍼-캐스나인(CRISPR-Cas9) 신약 소식으로 연말을 뒤흔든 분야인 '유전자치료제'가 보입니다.
마지막으로 '허가 불발'이라는 고배를 마신 신약들도 들여다봄직 합니다. 갓 구운 따끈한 2023년 FDA 테이프에 '뒤로감기' 버튼을 눌러 보겠습니다.
ⓛ 암·이중항체·RSV·알츠하이머
② 비만·화이자·중국·일본·유전자치료제
③ 허가 불발
Keyword 1. 도나네맙
본래 알츠하이머병 신약은 작년에 2개가 나왔어야 했습니다. 하나는 7월에 완전허가가 이뤄진 바이오젠(Biogen)과 에자이(Eisai)의 '레켐비(LEQEMBIㆍ성분 레카네맙 Lecanemab)', 다른 하나는 일라이릴리(Eli Lilly)의 '도나네맙(Donanemab)'입니다. 하지만 작년 1월에 가속승인(Accelerated approval)을 받았던 레켐비와 달리, 도나네맙은 같은 달에 가속승인 거절이라는 벽을 마주했습니다.
약효나 안전성에 중대한 문제가 있었던 건 아닙니다. 오히려 거절 이유는 '약효가 너무 빨리 나타나서'입니다. 미국 식품의약국(FDA)은 일라이릴리에 가속승인 거절을 통보하며 '최소 100명의 환자에게 최소 1년을 투약한 데이터를 가져올 것'을 주문했습니다. 일라이릴리의 임상시험은 인원수에서는 문제가 없었는데, 데이터가 부족했습니다.
일라이릴리의 가속승인 신청의 배경이 됐던 2상 임상시험인 '트레일블레이저-ALZ(TRAILBLAZER-ALZ)'는 기간을 정해 두고 투약하는 방식이 아니었습니다. 대신 일정 수준까지 '아밀로이드 플라크(Amyloid plaque)'가 제거됐을 때 투약을 멈추는 식이었습니다. 그런데 도나네맙을 투여받은 많은 환자들이 가장 이르게는 6개월 만에 목표했던 아밀로이드 플라크 감소치를 보이고 말았습니다. 생각보다 빠르게 약이 듣는 바람에, 1년이 넘게 투약한 환자 100명을 모으는 것이 힘들었던 겁니다.
어찌 보면 황당한 이유로 발을 헛디딘 일라이릴리는 어쩔 수 없이 완전허가를 목표로 재설정했습니다. 그리고 작년 5월, 3상 임상시험인 '트레일블레이저-ALZ 2(TRAILBLAZER-ALZ 2)'에서 1ㆍ2차 평가지표를 모두 달성했다는 소식을 알렸습니다. 이제 허가는 시간문제입니다. 다만 2023년 말까지는 허가가 될 것이라는 종전의 예상과는 달리, 13일 기준 아직까지는 허가가 이뤄지지 않았습니다.
Keyword 2. 오베티콜산
지난해 가장 큰 기대와 함께 가장 큰 아쉬움을 남긴 약물, 인터셉트파마슈티컬스(Intercept Pharmaceuticalsㆍ이하 인터셉트)의 '오베티콜산(Obeticholic acidㆍOCA)'입니다. '오칼리바(OCALIVA)'라는 원발성 담즙성 담관염(PBC) 치료제로 허가돼 있는 성분인데요. 한때 '최초의 대사이상 관련 지방간염(Metabolic dysfunction-associated steatohepatitisㆍMASH) 치료제'란 타이틀에 가장 가까이 날아올랐던 신약 개발 업계의 '이카로스'라 하겠습니다.
허가를 향한 OCA의 여정은 험난하기만 했습니다. 인터셉트는 지난 2019년에 3상 임상시험인 '리제너레이트(REGENERATE)'에서 꽤 괜찮은 약효를 관찰했습니다. MASH의 진행 없이 간섬유화가 감소한 결과를 토대로 가속승인을 신청했지만, 하필이면 코로나19 팬데믹이 이때 발발해 버렸습니다. FDA는 심사 일정을 차일피일 미룰 수밖에 없었고, 2020년 6월이 돼서야 심사 결과를 알렸습니다.
하지만 심사 결과는 '승인 거절'이었고, 이유는 '섬유화 감소만으로는 MASH에 대한 약효를 장담할 수 없다'였습니다. '그린라이트'를 기대하며 영업사원까지 대폭 증원했던 인터셉트는 반발했지만, MASH-연관 간경화에 대한 임상 3상인 '리버스(REVERSE)'란 카드가 남아 있었습니다. 또 REGENERATE 임상시험 결과를 재해석해 정식 허가를 신청할 여지도 남아 있었기에 일단은 훗날을 기약하게 됩니다.
2년 뒤인 2022년에 이르러 REVERSE 임상시험의 결과가 발표됐지만, 그 내용은 암울했습니다. 1차 평가지표 충족에 실패했던 것인데요. 마지막 카드인 'REGENERATE 재해석'까지 애매한 결과를 냈던 터라, 이때부터 인터셉트의 명운에 먹구름이 드리워졌습니다. 결국 1년 뒤인 2023년 REGENERAGE 재해석 결과로 신청됐던 허가 심사에서 FDA의 최종 거절 결정이 내려지며 OCA의 여정은 끝을 맞이했습니다. 이렇게 OCA 개발로 탈진해 버린 인터셉트는 작년 9월에 알파시그마(Alfasigma)에 인수됐습니다.
한편 MASH 신약의 바통을 이어받은 후보물질은 마드리갈파마슈티컬스(Madrigal Pharmaceuticals)의 '레스메티롬(Resmetirom)'인데요. 임상 3상에서 MASH 치료 효과를 보여 현재 허가 심사가 진행 중입니다. 심사 결과는 올해 1분기 내 나올 것으로 알려졌습니다.
Keyword 3. 주르주베
바이오젠(Biogen)는 꿈이 있었습니다. '아두헬름(ADUHELMㆍ성분 아두카누맙 Aducanumab)'으로 '최초의 치매 치료제' 타이틀을 거머쥔 뒤, '레켐비(LEQEMBIㆍ성분 레카네맙 Lecanemab)'로 치매 시장을 굳히는 것이었습니다. 그 후 세이지(Sage)와 공동 개발한 '주르주베(ZURZUVAEㆍ성분 주라놀론 Zuranolone)로 신경질환 분야에서도 일가를 이루는 것이 단꿈의 피날레였습니다.
애석하게도 그 꿈은 '반타작'에 그칠 듯합니다. 시리즈 1편의 기사에서 소개했듯, 레켐비는 시장에 당당히 걸어 들어갔지만, 아두헬름은 시장 바닥에 뒹굴었습니다. 또 주르주베는 목표했던 적응증 2개 중 1개에 대한 허가만을 얻어냈습니다. 그나마 하나는 허가를 받았으니 다행일지도 모르지만, 허가에 실패한 적응증이 훨씬 더 큰 시장을 이루고 있다는 게 아쉬운 점입니다.
바이오젠과 세이지는 작년 8월에 FDA로부터 2통의 편지를 받았습니다. 하나는 주르주베를 산후 우울증(Postpartum depressionㆍPPD) 치료제로 허가한다는 내용이었고, 다른 하나는 주요 우울 장애(Major depressive disorderㆍMDD) 치료제로는 허가하지 못하겠다는 내용이었습니다. FDA는 "MDD에 대한 약효에 충분한 근거가 없었다"며 추가적인 임상시험을 진행할 것을 주문했습니다.
FDA의 결정은 예견 가능했던 결과이기도 했습니다. MDD에 대한 임상 3상은 2개로 나눠 진행됐는데, 둘 모두 신통치 못한 데이터를 냈습니다. '마운틴(MOUNTAIN)' 임상시험에서는 주르주베 20㎎ㆍ30㎎이 투여됐지만, 1차 평가지표를 충족하지 못했습니다. 비보를 받아들이지 못한 세이지는 투약 스케줄을 따르지 않은 환자와 경증 환자를 데이터에서 제외하면서 사후분석(Pot-hoc analysis)을 실시하는 등 '몸부림'을 쳤습니다. 그렇게 낸 결과에선 약효가 일부 보였지만, 투자자들을 설득하기에는 역부족이었는지 시가총액의 절반가량이 증발해 버립니다.
이어 '워터폴(WATERFALL)' 임상시험에선 주르주베 50㎎ 투여가 1차 평가지표를 충족하는 결과를 냈습니다. 이렇게 3개 용량 중 1개에서만 효과가 관찰됐다는 점과 효과가 나온 용량이 최대 용량이었다는 점은 결국 FDA가 고개를 가로젓게 했습니다.
바이오젠과 세이지가 추가 임상을 진행할지는 불분명한 상태인데요. 만약 그럴 계획이 없을 경우 PPD 치료제 시장에서 낼 수익으로 MDD 개발비용까지 회수 가능할지는 미지수입니다.

