FDA CDER·CBER, 2023년 각각 55개·17개 신약 허가
항암제 총 12개 허가… 이중항체 기술, 이젠 '대세'
최초의 RSV 백신도 나와… 새 예방항체도 25년 만에 등장
바이오젠, '아두헬름' 실패 딛고 2번째 알츠하이머 신약 '레켐비' 내놔

2024년의 첫 번째 주를 넘어가며 지난해를 돌아봅니다. 2023년 한 해 동안 미국 식품의약국(FDA)의 의약품평가연구센터(CDER)는 55개의 신약을, 생물의약품평가연구센터(CBER)는 17개의 신약을 허가했습니다. 2022년에 코로나19의 여파로 각각 37개ㆍ8개만을 허가했던 것에 비하면, 그 전년의 수준을 회복한 셈입니다.
이런 회복세 안에 주목할 만한 키워드들이 여럿 있습니다. 가장 큰 시장을 형성하고 있는 질환군인 '암'은 역시 올해도 빼놓을 수 없는 분야인데요. 그 중에서도 '이중항체' 기술이 적용된 신약 4개가 눈에 띕니다.
질환을 키워드로 조금 더 살피자면 'RSV(호흡기세포융합바이러스)' 감염증에 대한 최초의 백신이 작년에 탄생했습니다. '알츠하이머(Alzheimer's)' 분야에서는 지난 2021년에 이어 2번째 신약이 등장했고, 이젠 글로벌 메가 트렌드가 된 '비만' 치료제도 하나 더 나왔습니다.
회사를 중심으로 보자면 작년에 가장 많은 신약을 허가받은 '화이자(Pfizer)'가 주목할 만하고, 국가를 중심으로 보면 '중국과 일본'이 상당한 성과를 냈다는 것도 흥미로운 부분입니다. 그리고 모달리티(Modality)로 렌즈를 갈아끼워 보면, 최초의 크리스퍼-캐스나인(CRISPR-Cas9) 신약 소식으로 연말을 뒤흔든 분야인 '유전자치료제'가 보입니다.
마지막으로 '허가 불발'이라는 고배를 마신 신약들도 들여다봄직 합니다. 갓 구운 따끈한 2023년 FDA 테이프에 '뒤로감기' 버튼을 눌러 보겠습니다.
ⓛ 암·이중항체·RSV·알츠하이머
암·이중항체

작년에 허가된 항암제는 △'오서두(ORSERDUㆍ성분 엘라세스트란트 Elacestrant)' △'자이니즈(ZYNYZㆍ성분 레티판리맙 Retifanlimab)' △'엡킨리(EPKINLYㆍ성분 엡코리타맙 Epcoritamab)' △'컬럼비(COLUMVIㆍ성분 글로피타맙 Glofitamab)' △'밴플리타(VANFLYTAㆍ성분 퀴자티닙 Quizartinib)' △'탈베이(TALVEYㆍ성분 탈퀘타맙 Talquetamab)' △'엘렉스피오(ELREXFIOㆍ성분 엘라나타맙 Elranatamab)' △'록토르지(LOQTORZIㆍ성분 토리팔리맙 Toripalimab) △'프루자클라(FRUZAQLAㆍ성분 프루퀸티닙 Fruquintinib)' △'오그티로(AUGTYROㆍ성분 레포트렉티닙 Repotrectinib)' △'옥시베오(OGSIVEOㆍ성분 니로가스타트 Nirogacestat)' △'트루캅(TRUQAPㆍ성분 카피바서팁 Capivasertib)' 등 총 12개입니다.
이 중 엘렉스피오ㆍ탈베이ㆍ컬럼비ㆍ엡킨리엔 이중항체 기술이 접목됐습니다. 엘렉스피오는 BCMAㆍCD3에, 탈베이는 GPRC5DㆍCD3에, 컬럼비와 엡킨리는 CD20ㆍCD3에 결합합니다. 이들은 모두 암세포와 T세포를 물리적으로 연결시켜 암세포 사멸을 돕는 'T 세포 인게이저(T-cell engager)'입니다.
2023년에 허가된 12개 항암제 중 4개씩에나 이중항체 기술이 쓰였다니, 확실히 '대세'인 기술이 맞는 듯합니다. 이중항체 기반 신약은 2014년ㆍ2017년ㆍ2021년에 1개씩 허가된 후 2022년에만 4개가 허가된 바 있습니다. 작년에도 그 흐름을 이어간 것이라고 보면 되겠습니다.
이러한 흐름을 주도하고 있는 제약사는 역시 로슈(Roche)일 겁니다. 여태 허가된 이중항체 약물 11개 중 '헴리브라(HEMLIBRAㆍ성분 에미시주맙 Emicizumab)'ㆍ'바비스모(VABYSMOㆍ성분 파리시맙 Faricimab)'ㆍ'룬수미오(LUNSUMIOㆍ성분 모수네투주맙 Mosunetuzumab)'ㆍ컬럼비 등 4개 약물이 모두 로슈의 제품입니다. 세계 이중항체 시장에서 발생하는 대부분의 매출이 이들 제품의 것이기도 합니다.
한국의 바이오텍ㆍ제약사도 이중항체 물결에 제대로 올라탔습니다. 해당 분야의 선두주자라 부를 수 있는 에이비엘바이오의 이중항체 'ABL301(개발코드명)'이 사노피(Sanofi)에 조 단위로 기술수출됐던 사실을 기억할 겁니다. 회사는 '그랩바디(Grabbody)-B'ㆍ'그랩바디-T'ㆍ'그랩바디-I'라는 이중항체 플랫폼을 운용하고 있기도 합니다.
또 셀트리온은 지난달 싸이런테라퓨틱스(Cyron Therapeutics)와 이중항체ㆍ삼중항체 개발을 위한 공동 연구 계약을 맺었습니다. 종근당은 폐암 치료제 'CKD-702'에 대한 임상 1상을 마친 상태고, 앱클론은 류머티즘 관절염 치료제 'AM201'ㆍ고형암 치료제 'AM105'에 대한 전임상 개발을 진행 중입니다. FDA의 신약 허가 소식에서 한국의 이중항체 약물을 보게 될 날이 기다려집니다.
RSV
호흡기세포융합바이러스(RSV) 감염증은 감기와 유사한 증상을 나타냅니다. 대부분의 환자들은 1~2주 내에 회복된다는 점도 감기와 유사합니다. 다만 영유아와 노인이 감염될 경우 심각한 합병증으로 이어질 수도 있습니다.
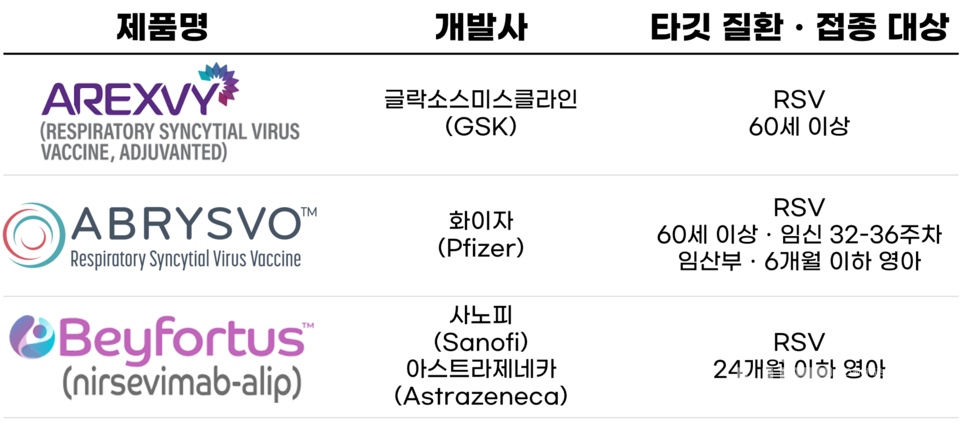
문제는 오랜 시간 동안 RSV에 대한 백신이 존재하지 않았다는 것인데요. 2종의 백신과 1종의 예방항체가 작년에 한꺼번에 등장하며 해묵은 염원에 화답했습니다. 글락소스미스클라인(GSK)의 '아렉스비(AREXVY)', 화이자(Pfizer)의 '아브리스보(ABRYSVO)', 사노피(Sanofi)ㆍ아스트라제네카(Astrazeneca)의 '베이포투스(BEYFORTUSㆍ성분 니르세비맙 Nirsebimab)'가 해당 소식의 주인공들입니다.
아렉스비와 아브리스보는 백신입니다. 아렉스비의 접종 대상은 60세 이상 노인층이며, 아브리스보의 접종 대상은 60세 이상 노인층ㆍ임신 32~36주차 임산부ㆍ6개월 이하 영아입니다. 아렉스비는 작년 3분기에만 7억900만파운드(약 1조2000억원)의 매출을 냈고, 아브리스보는 같은 기간 동안 3억7500만달러(약 5000억원)를 벌어들였습니다. 적어도 RSV 백신 판매 실적에선 GSK가 화이자를 저만치 따돌린 셈입니다.
그런가하면 베이포투스는 전통적인 의미의 백신은 아닙니다. 하지만 RSV 감염증을 예방한다는 점에서는 백신과 유사한 기능이 있습니다. 베이포투스는 RSV의 F 당단백질에 결합하는 항체로, RSV가 체내세포와 결합하지 못하도록 막아 결과적으로 감염 경로를 차단합니다. 즉 신체가 스스로 면역력을 가지도록 유도해 능동면역(Active immunity)을 제공하는 백신과 달리, 외부에서 면역력을 전달해 수동면역(Passive immunity)을 제공하는 예방항체입니다.
RSV 예방항체는 이미 시장에 나와 있긴 했습니다. 지난 1998년 FDA에서 허가된 메디뮨(MedImmune)의 '시나지스(SYNAGISㆍ성분 팔리비주맙 Palivizumab)'는 25년간 외로이 RSV와 사투를 벌여왔습니다. 다만 체내에서 지속되는 시간이 짧아 RSV 유행 기간 동안 매달 접종이 필요하다는 점과 특정 위험군에 속한 영아나 특정 기저질환을 가진 환자에만 투약이 가능했다는 점이 한계로 지적돼 왔습니다. 이에 비해 베이포투스는 4~6개월에 걸쳐 면역력을 제공하는데다, 24개월 미만 영아에게 건강 상태와 큰 상관없이 투여가 가능합니다.
알츠하이머병

지난 2021년, 알츠하이머병 진행을 억제하는 최초의 치료제인 바이오젠(Biogen)의 '아두헬름(ADUHELMㆍ성분 아두카누맙 Aducanumab)'이 가속승인(Accelerated approval)을 통해 시장에 발을 딛었습니다. 하지만 많은 이들이 석연치 않은 눈길을 보냈는데요. 임상시험에서 경증 알츠하이머병 환자의 아밀로이드 베타(Amyloid beta)를 효과적으로 제거한 것은 확인됐지만, 이런 결과가 인지능력 개선 등 실제 체감되는 약효로 이어지는지는 불명확했기 때문입니다. 이에 허가 과정에서부터 FDA 외부 자문위원들이 아무도 아두헬름의 승인에 투표하지 않은데다 몇 명은 항의의 표시로 사임마저 강행했습니다.
출시 후 얼마 지나지 않아 약값을 반토막내기까지 한 바이오젠은 2022년 5월 아두헬름의 상용화 인프라를 최소화하겠다 발표하며, 사실상 상용화를 포기하기에 이르렀습니다. 그리고는 후속 알츠하이머병 신약 개발에 집중하겠다고 밝혔는데요. 그 결실이 바로 에자이(Eisai)와 공동 개발해 작년에 허가가 이뤄진 '레켐비(LEQEMBIㆍ성분 레카네맙 Lecanemab)'입니다.
레켐비도 아두헬름처럼 가속승인 트랙을 통해 허가를 받았습니다. '아두헬름처럼 얼렁뚱땅 허가가 된 건 아니냐'는 우려가 들 법도 하지만, 레켐비는 달랐습니다. 대규모 임상 3상이었던 '클레어리티 AD(Clarity AD)'에서 레켐비 투여군은 18개월간 위약군에 비해 인지ㆍ기능 저하가 27% 낮았던 것으로 나타나는 등 실질적인 약효가 관찰됐기 때문입니다. 이런 결과를 토대로 레켐비는 FDA 외부 자문위원들의 전원 허가 찬성이란 축복 속에 작년 7월에 완전 허가를 받아 알츠하이머병 치료 시장에 안착했습니다.
레켐비의 국내 도입 절차도 시작됐습니다. 작년 6월 바이오젠과 에자이는 식품의약품안전처에 품목허가를 신청했고, 올해 하반기에 허가돼 내년 중 출시될 것으로 전망됩니다. 다만 항상 그렇듯 문제는 약값으로, 2만6500달러(약 3500만원)라는 높은 가격이 책정돼 보험급여 등재가 필수적일 것으로 보입니다.
아울러 국내 기업들도 알츠하이머병 치료제 개발을 이어가고 있습니다. 해당 기업으로는 △엔케이맥스 △아리바이오 △젬백스엔카엘 △디앤디파마텍 △브이티바이오 △지엔티파마 등 6개 기업이 임상에 진입했고 △이수앱지스 △메디프론 △동아에스티는 전임상 개발 혹은 개발 검토 단계에 있습니다.

