'벤자카프토' 3중 병용, '트리카프타' 효능 능가…기존 치료제 미반응군 대응
mRNA 치료제까지 적용하면 낭포성 섬유증 환자군 대부분 치료 가능할 전망
비마약성 진통제·낫적혈구병·1형 당뇨병 파이프라인도 후기 임상 접어들어

낭포성 섬유증(Cystic Fibrosis) 치료업계 최강자로 불리는 미국 버텍스(Vertex Pharmaceuticals)가 '시장 굳히기'를 선언했다. 비마약성 진통제ㆍ낫적혈구병ㆍ제1형 당뇨병 파이프라인에 대해서도 자신감을 드러내며, 낭포성 섬유증 시장 너머로 사업 저변을 넓히겠다고 밝혔다.
지난 11일부터 14일(현지 시각) 미국 뉴욕에서 200여개 기업들과 진행된 '제21회 모건 스탠리 헬스케어 콘퍼런스(Morgan Stanley Healthcare Conference)'에서 버텍스는 13일 주최 측과 담화(Fireside Chat)를 통해 신약 파이프라인 개발 계획을 알렸다. 담화에는 레쉬마 케왈라마니(Reshma Kewalramani) 버텍스 대표와 찰리 와그너(Charlie Wagner) 최고재무책임자(CFO)가 참여했다.

케왈라마니 대표는 "버텍스는 언제까지나 낭포성 섬유증 전문기업을 표방할 것이며, 이는 변하지 않을 것"이라며 "여기 더해 낭포성 섬유증 밖으로도 전문 분야를 넓혀갈 것이며, 단기 목표는 △비마약성 진통제 △낫적혈구병과 베타 지중해빈혈 △제1형 당뇨병"이라고 말했다.
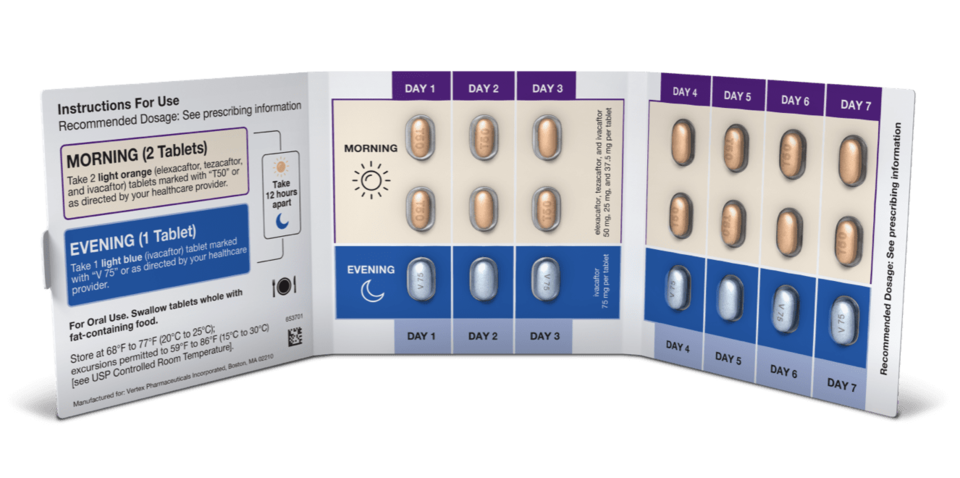
현재 낭포성 섬유증의 약물 치료는 대부분 버텍스 제품인 △트리카프타(TRIKAFTAㆍ성분 엘렉사카프토elexacaftor+테자카프토tezacaftor+아이바카프토ivacaftor) △심데코(SYMDEKOㆍ성분 테자카프토+아이바카프토) △오캄비(ORKAMBIㆍ성분 루마카프토lumacaftor+아이바카프토) △칼리데코(KALYDECOㆍ성분 아이바카프토)로 이뤄진다. 모두 낭포성 섬유증의 핵심 병인인 CFTR(Cystic Fibrosis Transmembrane Conductance Regulator)을 조절하는 기전이다.
낭포성 섬유증 환자의 90%는 버텍스의 기존 약물들에 반응하지만, 나머지 10%는 해결해야 하는 숙제로 남아 있는 상태다. 케왈라마니 대표는 "낭포성 섬유증 치료에 있어 버텍스가 가져가는 가장 큰 목표 중 하나는 나머지 10%의 환자들을 위한 약을 개발하는 것"이라며 "임상 3상 개발 중인 '벤자카프토(Vanzacaftor)' 3중 병용 제제(테자카프토+듀티바카프토Deutivacaftor)가 여기에 대응한다"고 말했다.
그는 이어 "벤자카프토 3중 병용은 임상 2상 데이터로 미뤄볼 때 기존 트리카프타 요법을 능가하는 약효가 기대된다"고 덧붙였다. 벤자카프토 3중 병용 임상 3상은 올해 말 투여가 완료돼 내년 초에 초기 결과가 나올 것이라는 게 케왈라마니 대표의 설명이다.
이날 버텍스는 낭포성 섬유증 환자군 대부분을 각기 다른 기전의 약물들로 모두 치료하겠다는 전략을 분명히 하며 '시장 굳히기'에 들어갈 것임을 시사했다. 기존 약물에 반응하는 환자들은 계속해서 트리카프타 등을 투여하고, 기존 약물에 미반응하는 환자는 벤자카프토 3중 병용으로 대응하며, 미반응 환자 중에서도 CFTR이 미발현하는 환자는 mRNA 약물인 'VX-522(개발코드명)'로 치료한다는 것이 전체 전략의 개요다.
케왈라마니 대표는 "모더나와 파트너십 아래 개발 중인 VX-522 또한 '나머지 10%의 환자'를 위한 약물"이라며 "현재 임상 1상의 단일용량상승(Single Ascending DoseㆍSAD)군 시험이 진행 중으로, 차후 다회용량상승(Multiple Ascending DoseㆍMAD)군 투여가 이뤄지면 본격적인 약효가 관찰될 것으로 본다"고 전망했다.
그는 또 "자신감 넘치는 열정"이라는 표현으로 비마약성 진통제로 개발 중인 'VX-548'에 대한 강한 기대감을 보이며, 주요 사업영역인 낭포성 섬유증 너머 타 질환으로의 확장 전략을 밝혔다. 발표에 따르면 VX-548의 성공 가능성이 높게 점쳐지는 이유는 VX-548의 전 세대 물질이었던 'VX-150'에서 약물 타깃인 NaV1.8 수용체의 반응성이 약리적으로 검증됐고, 현재 진행 중인 VX-548의 임상 3상 이전에 건막류 절제수술(Bunionectomy)ㆍ복부성형술(Abdominoplasty) 통증 감소 임상 2상에서 효능이 이미 관찰됐기 때문이다. 이에 케왈라마니 대표는 "임상 2상에서 보여준 결과만 그대로 재현돼도 '홈런'을 치는 것"이라고 강조했다.
품목 허가 검토 단계에 접어든 낫적혈구병ㆍ베타 지중해빈혈 치료제 '엑사셀(EXA-CEL)'의 경우 향후 출시 시기에 맞춰 상업화 채비가 이뤄지고 있다. 와그너 CFO는 "영업부 충원과 의학부 활동 준비가 완료됐으며, 공급망도 준비된 상태"라며 "준비할 수 있는 것은 모두 준비했다"고 말했다. 이날 와그너 CFO가 밝힌 바에 따르면, 엑사셀은 미국 시장의 50%와 유럽 시장의 25% 점유를 목표로 한다.
버텍스는 이어 엑사셀의 입지에 버금가는 약물로 제1형 당뇨 세포치료제 'VX-880'과 'VX-264'도 소개했다. VX-880과 VX-264는 동종줄기세포 유래 섬세포(Allogenic stem cell-derived islet cell)다. 전자는 면역억제제와 함께 투여되며, 후자는 캡슐화돼 면역억제제 없이 투여되는 약물이다. 특히 VX-880의 경우, 지난 2021년 마무리된 임상 2상에서 하루 34회에 달했던 제1형 당뇨병 환자의 인슐린 투여량을 하루 2.9회로 줄이며 큰 주목을 받은 바 있다.
담화 막바지에 케왈라마니 대표는 3번째 제1형 당뇨 세포치료제의 존재도 언급했다. 케왈라마니 대표는 "VX-880과 VX-264에 쓰이는 세포에 유전자 편집을 가한 파이프라인도 전임상 개발 단계에 들어갔다"며 "해당 파이프라인은 체내 투여 후 면역회피 기전을 가질 수 있도록 설계됐다"고 말했다.

