허가총괄담당관, 24일 2023년 상반기 의약품 허가업무 설명회 개최
올해 10월부터 15일부터 '경구용, 무균 이외제제' 전문약 생동 대상 추가

올해부터 원료의약품 변경등록 처리기한이 단축되고, 완제의약품의 주성분 복수규격 인정 범위가 확대가 추진되는 등 허가업무 변화가 예상된다.
식품의약품안전처는 24일 서울 강남구 소재 한국과학기술회관에서 의약품 허가·신고 업무를 담당하는 제약업계 관계자를 대상으로 '2023년 상반기 의약품 허가업무 설명회'를 개최했다.
이번 설명회에서는 △2023년 업무계획 및 제도변경사항 △CTD(국제공통기술문서, Common Technical Data) 제조방법 등 허가신청 등 내용이 안내됐다.
허가·등록제도 변경사항

문현주 식약처 허가총괄담당관 연구관은 최근 도입 혹은 시행될 예정인 △원료의약품 변경등록 처리기한 단축 △전문의약품 생동시험 대상 확대 △완제의약품의 주성분 복수규격 인정 등 절차에 관해 설명했다.
허가총괄담당관에 따르면, 최근 원료의약품의 단순 업데이트나 완제 연계 심사 중에 보안이 발생했을 경우, 변경등록을 신청하는 처리 기한이 너무 길다는 건의가 지속 제기된 것으로 나타났다.
문현주 연구관은 "이에 따라 원료의약품 등록과 관련 작년 12월 28일에 총리령 '의약품 등의 안전에 관한 규칙'이 개정 및 시행됐다"며 "등록된 원료의약품 자료 중 제15조제1항2호가목부터 다목까지의 자료를 변경하는 경우 기존 120일에서 20일로 대폭 단축한다"고 설명했다.
또한 "원료의약품 중 현장 조사가 불필요한 경우에는 등록 및 등록변경 시 90일의 처리기간이 부여된다"고 설명했다.
의약품 등의 안전에 관한 규칙 제15조제1항2호의 가~다목에 해당하는 자료는 △물리화학적 특성과 안정성에 관한 자료 △제조방법, 포장, 용기 및 취급상의 주의사항 등에 관한 자료 △원료의약품의 시험성적서, 분석방법 및 사용된 용매 등에 관한 자료 등이다.
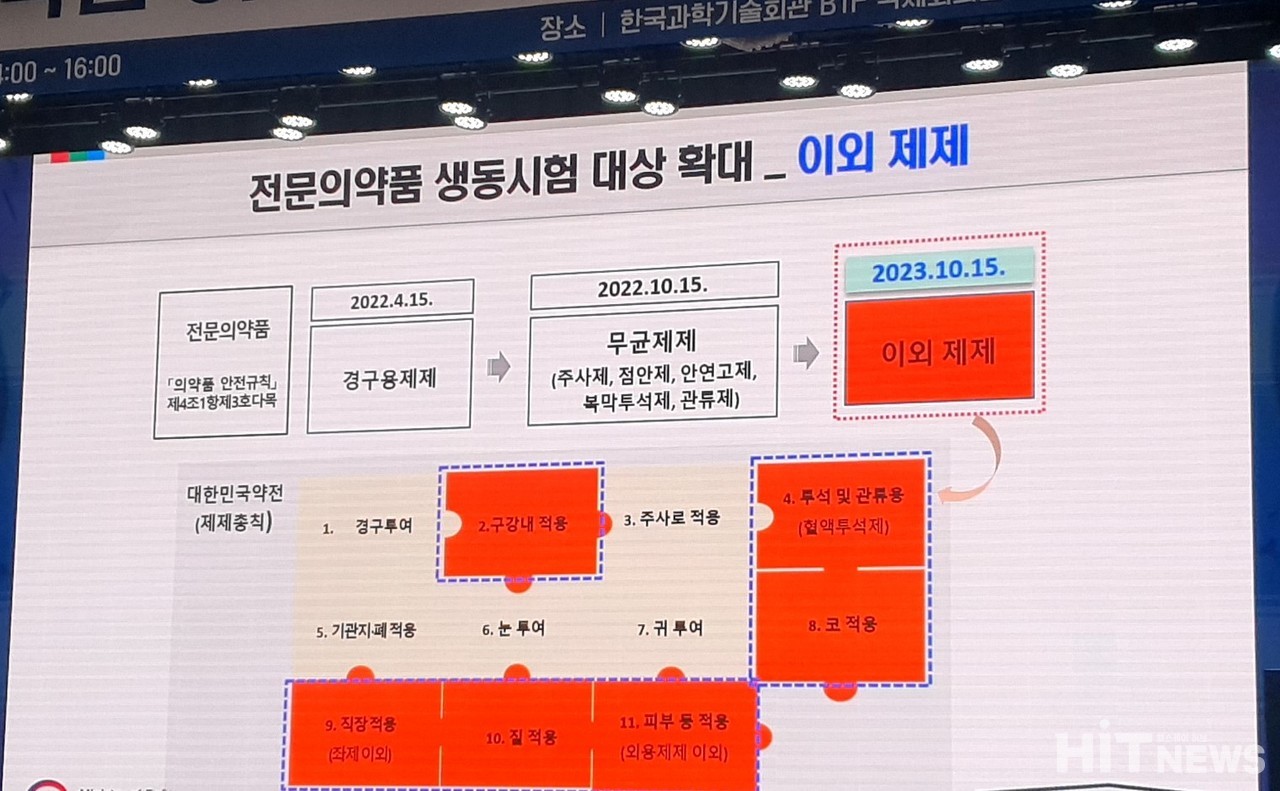
아울러 전문의약품 생동시험 대상이 작년 4월 15일 경구용제제, 10월 15일 무균제제(주사제, 점안제, 안연고제, 복막투석제, 관류제)로 확대된 것에 이어, 오는 10월 15일부터 그 외 제제로도 대상이 확대된다. 대상 제제는 대한민국약전 '제제총칙'에 정의된 △구강내 적용 △주석 및 관류용 △코 적용 △직장 적용(좌제 이외) △질 적용 △피부 등 적용(외용제제 이외) 등 전문의약품 제제다.

또한 완제의약품의 주성분 복수규격 인정의 범위를 확대가 추진된다. 식약처는 원료의약품의 예기치 못한 공급 상황에 대비해 완제의약품 주성분 복수규격 인정 범위의 확대가 필요하다는 입장이다.
문 연구관은 "이 내용은 작년 식약처 규제혁신 100대 과제 중 하나로 선정돼 추진되고 있으며, 감기약의 경우 작년 11월부터 안정 공급을 위해 주성분 복수 규격을 인정하고 있다"고 설명했다.
이어 "현재 완제의약품의 주성분 규격은 일반적으로 1개로 허가하고, 공정서 규격에 적합한 성분에 한해 복수규격을 인정하고 있다"며 "앞으로는 주성분 규격 차이가 완제 품질에 영향이 없음을 입증한다면 별규로 추가 가능하다"고 소개했다.
주요 제출 자료
원료의약품
-'의약품 품목허가·신고·심사 규정'
제5조제1항제2호가목4 = ①신청규격
제5조제1항제2호가목5 = ②신청 규격의 타당성 자료(기준설정 근거, 시험방법 밸리데이션 등') ③불순물 고찰 및 근거자료 ④복수규격 간 비교분석 및 고찰자료(DMF 번호 등 규격 간 비교표 등)
제5조제1항제2호가목6 = ⑤신청 규격별 시험성적서(공급처 성적서 등)’
완제의약품
제5조제1항제2호나목4 = ⑥복수규격 간 차이가 완제의약품의 품질에 영향이 없음을 입증하는 자료
의약품동등성 시험기준 제3조제1항제4호 = ⑦(해당하는 경우) 의약품동등성시험자료
단, 복수규격 설정과 별개로 제출이 필요한 자료는 목록에서 제외한다.
2023년 주요 업무 계획

문 연구관은 허가총괄담당관이 추진하고 있는 올해 주요 계획에 대해 설명했다.
그는 "의료제품 '공식소통채널(공소채)' 운영 범위를 확대한다"며 "2021년 신약 정식 운영, 2020년 첨단바이오의약품 시범사업, 2022년 자료제출의약품 중 새로운 조성, 효능 의약품 시범사업 을 운영해온 것과 덧붙여 올해 6월부터 자료제출의약품 전체로 그 운영 범위를 확대할 예정"이라고 밝혔다.
또한 올해부터 식약처 허가총괄담당관은 의료제품 허가현황을 공개한다.
공개 범위는 △신의료제품(신약, 희귀의약품, 신물질 함유 의약외품, 신개발 의료기기, 희소 의료기기) 허가현황 개별 홍보 △의료제품 허가현황(매주 허가·인증된 의약품, 의약외품, 의료기기) △의약품 정보공개 현황(분기별로 신약, 자료제출의약품, 조건부 허가 품목, 생동 제네릭 신규 품목 등 허가보고서 공개) 등이다.
또한 2018년부터 운영해온 의약품 민·관 소통협의체 '팜투게더'를 주관하는 협회가 늘어난다.
기존에는 △한국제약바이오협회 △한국글로벌의약산업협회 △한국의약품수출입협회 등 3군데서 진행했지만, 올해부터는 한국바이오의약품협회도 주관협회로 참여한다. 팜투게더는 4월부터 각 협회 순서대로 격월(짝수달)로 개최할 예정이다.
아울러 식약처는 올해 지침서·민원인 안내서도 지속적으로 개정해 배포하겠다는 방침이다.
2023년 지침서·민원인 안내서 배포 계획
ㆍ3월 : 의약품 허가·심사 결과 정보공개 업무(GRP-MaPP-정보공개-1)
ㆍ5월 : 의료제품 허가·심사 공식 소통채널 운영 가이드라인
ㆍ6월 : 의약품의 품목허가·신고 체크리스트 및 세부 업무 매뉴얼(담당자용)
ㆍ7월 : 의약품 품목허가 및 신고 해설서, 개량신약 허가 사례집
ㆍ9월 : 의약품동등성시험 대조약 선정 가이드라인
ㆍ10월 : 완제의약품 중심 허가 심사 운영 관리 관련 질의응답집, 원료의약품 등록 및 변경등록 업무(GRP-MaPP-허가업무-4), 의약품 제조판매·수입 품목허가 및 허가사항 변경허가 업무(GRP-MaPP-허가업무-3)
ㆍ12월 : 의약품 허가샇아 검토 시 일반적 고려사항(GRP-MaPP-허가업무-1)

