특별기고 |
메디라마 임상개발본부 김세희 박사
엑소좀 치료제 임상개발을 위한 A to Z
엑소좀(exosome)은 세포에서 분비되는 나노사이즈(30~120nm)의 이중지질막 형태로 이뤄진 작은 소포체(vesicle)를 일컫는다. 그러나 세포에서 분비되는 다양한 형태의 소포체들이 발견되면서 넓은 의미의 세포 외 소포체(Extracellular vesicles, EVs)의 일부를 엑소좀이라고 할 수 있다.
급성장하는 엑소좀 연구 및 개발
엑소좀은 1983년 최초 발견 되었으며, 당시에는 생물학적 기능들이 밝혀지지 않아 세포가 내놓는 "Garbage bag"으로 인식되었다. 그러나 엑소좀에는 다양한 리간드, 세포유래 단백질, 성장인자, 핵산 등을 포함하고 있고 이를 이용해 세포간 정보교환에 중요한 역할을 한다는 것이 밝혀졌다. 세포가 내놓는 다양한 생체정보를 포함하고 있어 질병 진단 및 새로운 바이오 마커 발굴 연구에 사용되고 있으며, 세포의 신호전달에 영향을 주는 유효한 물질들을 이용한 치료제 개발, 약물을 탐지할 수 있는 이중지질막 구조를 이용한 약물전달체로도 개발되고 있다.
분비하는 엑소좀은 기존 세포배양시 버려지는 세포배양액에서 얻을 수 있어 세포를 연구하는 많은 연구자들에게 흥미를 유발했다. 미국 국립 의학도서관 문헌 검색 데이터베이스인 PubMed에 의하면, 2010년부터 논문 발표가 폭발적으로 증가하며, 작년 한 해 발표된 8721편을 포함해 2010년부터 2022년까지 총 4만6000건이 넘는 논문이 발표되었다. 이러한 논문 편수의 증가가 말해주듯, 많은 과학자들이 엑소좀에 열광하고 있다.

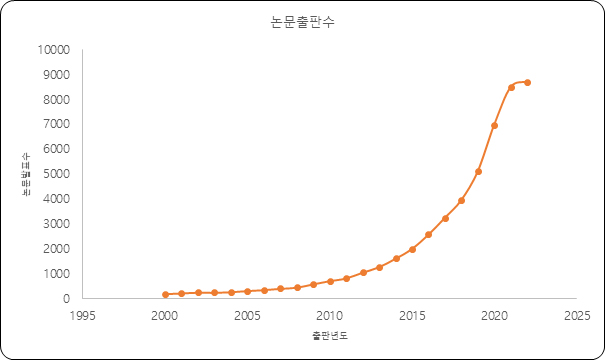
엑소좀의 시장 전망
활발한 연구개발과 함께 엑소좀 투자 및 시장규모도 폭발적으로 증가하고 있다. 글로벌 제약사인 로슈(Roche)는 유즙유래 엑소좀 플랫폼 기술에 10억 달러 규모의 투자를 진행했고 일본의 제약사 다케다(Takeda)는 에복스(Evox therapeutics)에 8억8200만 달러, 재즈 파마슈티컬스(Jazz Parmaceuticals)는 코디악 바이오사이언스(Codiak BioSciences)에 5600만 달러 규모의 투자를 하는 등 엑소좀 회사의 대규모 투자가 주목받기도 했다. 2019년 Markets and Markets 자료에 따르면 현재 엑소좀 치료제 시장은 연 평균 23.8%의 성장률로 2024년 2억 6,400만 달러 이상으로 성장할 것으로 추정된다.
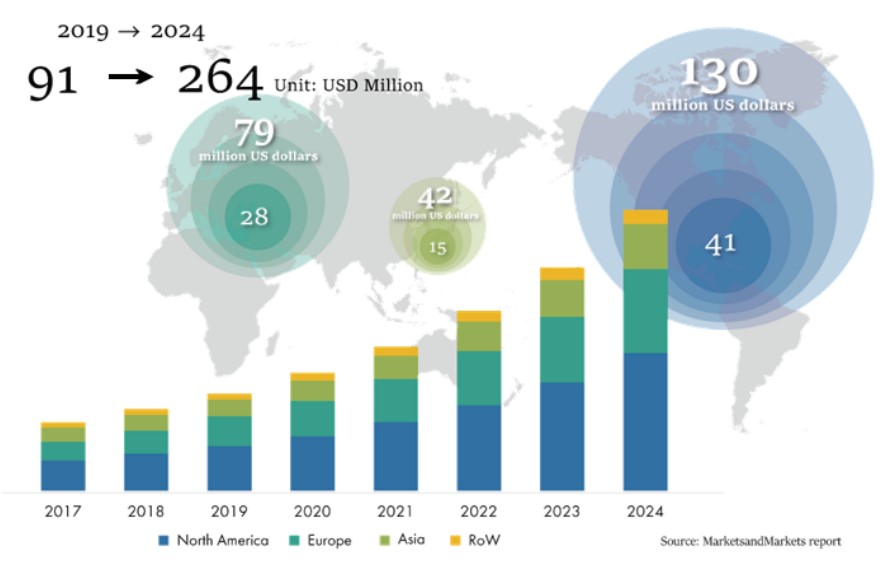
엑소좀 치료제의 개발
엑소좀은 기존의 세포치료제의 기능적 역할은 그대로 유지하면서 면역거부 반응, 암 유발, 혈관폐색과 같은 세포치료제의 안정성 이슈를 극복하고 살아있는 세포가 아니기 때문에 보관, 운송, 관리에 유리한 무세포 치료제(Cell-free therapeutics)로서 새로운 개념의 치료제로 인식되고 있다. 면역세포유래 엑소좀에 항암물질을 탑재하여 표적항암제 또는 면역항암제로 개발되고 있으며, 줄기세포 유래 엑소좀은 희귀 및 난치질환 치료제로 개발되고 있다.
전 세계적으로 엑소좀 치료제의 임상이 진행되고 있으며, ClinicalTrials.gov에 등록된 임상시험 자료에 따르면 총 33건이 등록되어 있으며 그 중 줄기세포 유래 엑소좀을 사용한 임상시험은 20건 (60.60%)으로 가장 높다. 코디악은 3종의 항암 엑소좀 치료제의 임상을 진행하고 있고, 에이글(Aegle Therapeutics)은 수포성 표피 박리증(EB, Epidermolysis Bullosa)의 임상을 진행하고 있어 그 결과에 주목하고 있다. 우리나라에서도 많은 엑소좀 회사들이 치료제 개발에 매진하고 있고, 일리아스바이오(ILIAS Biologics)와 브렉소젠(Brexogen)이 각각 호주와 미국에 임상을 승인 받았다. 그럼에도 불구하고 우리나라에서는 단 한 건의 임상 승인도 보고되고 있지 않다. 엑소스템텍이 작년 4월 식약처에 임상 승인 신청을 했지만, 올해까지도 아직 승인 소식은 들리지 않는다.
엑소좀 치료제 개발의 중요한 성공 요인
필자의 경험에 따르면 현재 국내의 엑소좀 치료제 개발사들은 세포치료제 개발과 유사한 가이드 라인에 따라 엑소좀 품질관리를 진행해 왔다. 2018년 “세포외소포치료제 품질, 비임상 및 임상평가 가이드라인(안내서-0917-01)”이 제정되었고, 2021년 “줄기세포 유래 세포외소포치료제 품질, 비임상 평가정보집”이 발간되었다. 그럼에도 불구하고 이질성(heterogeneity)이 높은 엑소좀을 치료제로서 개발한다는 것은 아직도 큰 어려움이 있다.
모든 치료제들은 생산되는 배치 마다의 일관성(consistency)과 동등성(comparability)이 유지되어야 한다. 특히, 살아있는 세포치료제나 세포 유래 엑소좀 치료제는 세포의 상태나 미세환경에도 영향을 받기 때문에 배치 마다의 특성 분석 값들의 변화도(variation)를 관리하는게 치료제 개발의 핵심이라고 할 수 있다. 아래 그림에서도 알 수 있듯이 세포로부터 유래하는 엑소좀들은 다양한 형태로 존재하고 있고 크기도 다양하고 지질막에 있는 분자들 그리고 엑소좀 내의 분자들이 엑소좀 마다 각각 다르게 분포되어 있다.
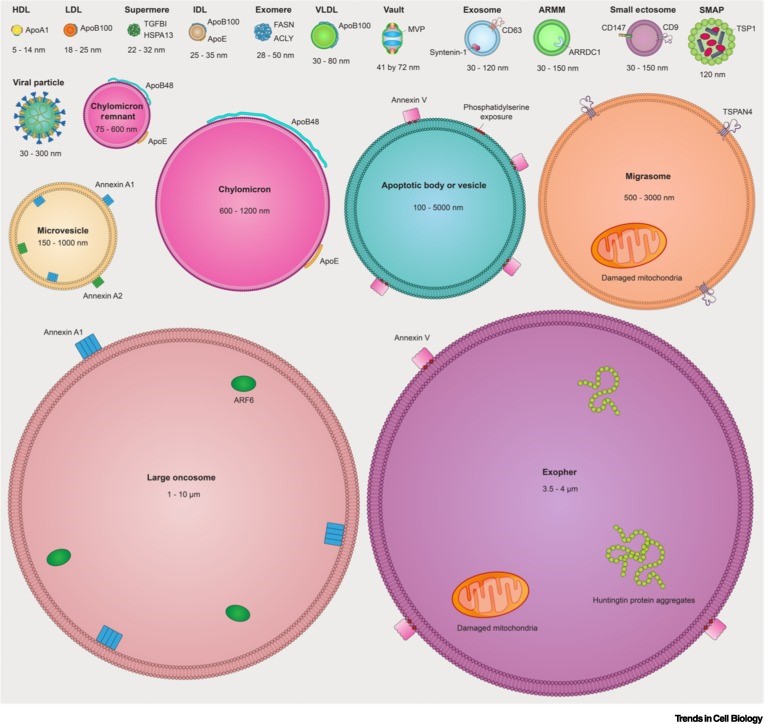
이러한 엑소좀의 이질성은 엑소좀 본래의 특성이지만, 일관성과 동등성을 유지해야 하는 치료제 개발시 큰 어려움으로 인식되고 있다.
① 이질성이 높은 엑소좀을 치료제로 개발하려면 어떤 것들을 고려해야 할까?
치료제 개발의 핵심은 CMC라고 할 수 있는데, Chemistry 즉, 제품의 특성 Manufacturing 즉, 제조공정 마지막으로 Control 앞의 두 개를 관리하라는 뜻이다. 엑소좀 치료제의 개발에 있어서는 제조공정의 핵심인 분리 방법의 선택과 제품 품질관리의 핵심인 밸리데이션된 정량 및 정성 분석방법이다.
엑소좀의 출발물질은 세포다. 결국 세포 자체가 엑소좀의 특성에 영향을 미치므로, 세포배양 단계에서 부터 특성 및 제조공정 관리가 이뤄져야 한다. 엑소좀을 연구하는 사람들은 다 알겠지만, 엑소좀 분리방법에는 표준화(gold standard)된 방법이 없다. 결국 분리 방법에 따라 모두 다 다른 엑소좀이 얻어진다는 얘기다. 분리 방법에 따라 엑소좀의 특징이 바뀌므로 타깃하는 질환에 어떤 분리방법으로 얻어진 엑소좀이 뛰어난 기능적 효과가 있었는지를 연구단계에서 찾아내야 한다.
② 많은 환자에게 쓰일 수 있는 충분한 양과 치료효과가 없다면 약으로 개발할 이유가 있을까?
엑소좀 분리법은 매우 다양한데 폴리에틸렌글리콜(PEG, Polyethylene Glycol)을 이용한 침전법과 초원심분리법(UC, differential ultra-centrifuge), 초여과법(Ultrafiltration), 순환형여과법(TFF, Tangential Flow Filtration)이 다량의 엑소좀을 수득할 수 있기 때문에 가장 많이 사용되고 있다. 그러나 잔여 단백질이나 엑소좀이 아닌 물질들이 함께 분리되어 순도(purity)가 좋지 않다. 순도가 높은 엑소좀을 얻기 위해 사이즈에 따른 크로마토 그래피(SEC, Size Exclusion Chromatography), 밀도구배(Gradient UC or density Gradient Ultracentrifugation), 친화도 포집(Affinity Isolation)법 등의 분리방법을 적용하고 있지만 높은 순도에도 불구하고 얻어지는 엑소좀의 양이 적어 비임상 및 임상진입에 어려움이 있다. 직접 실험실에서 여러가지 분리 방법에 따라 얻어진 엑소좀들로 유효성 평가를 진행해보면, 순도 높은 엑소좀을 분리했다고 해도 치료제 효과가 월등히 좋아지는 것도 아니다. 분리 방법 선택시 고려해야 할 것들은 충분한 엑소좀 수득양, 치료효과, 순도 등이 있다. 그 중 중요한 것은 충분한 양과 확실한 치료적 효과 이다. 순도는 기타 부작용 및 안정성 이슈로 연결되지 않도록 관리하면 된다.
③ 엑소좀의 총량을 세포치료제 처럼 개수로 나타내는 것이 현실적일까?
엑소좀 치료제의 품질 및 특성을 관리하기 위해서는 정성분석과 정량분석이 핵심이라고 할 수 있다. 엑소좀의 총량을 측정하기 위해서는 엑소좀의 입자갯수나 총 단백질량을 측정하는데, 입자수를 측정하기 위해서 가장 많이 쓰이는 방법은 나노입자 추적분석(NTA, nanoparticle tracking analysis)이다. NTA는 엑소좀의 크기 분포도와 개수를 함께 측정할 수 있는 장점이 있다. 그러나 필자의 경험에 따르면 측정시 엑소좀이 아닌 물질들의 응집체들도 입자로 찍힐 수 있고 엑소좀이 뭉쳐있는 경우도 있어 오차 값이 크다는 단점이 있다. 총 단백질 량을 측정하더라도 입자 개수와의 높은 상관관계를 보이지 않는 경우가 많다.
엑소좀의 표면단백질로 알려진 CD63, CD81, CD9과 같은 테트라스패닌(tetraspanin)은 엑소좀을 확인하는 마커이다. 이러한 마커들의 양을 측정하기 위해, 웨스턴 블랏팅(western blotting) 방법으로 특정 항체 결합 방식을 이용하여 측정이 가능하지만, 반정량에 가깝고 5ug 이상의 꽤 많은 엑소좀 양을 필요로 한다. 시중에 판매되고 있는 효소결합 면역흡착 분석법(ELISA, Enzyme-Linked Immunosorbent Assay) 키트들은 대부분 나노그램 단위의 단백질에서 유의미한 값을 검출할 수 있는데, 이러한 ELISA kit를 이용하여 순도 높은 엑소좀을 나노그램 단위에서 검출하려면 너무도 많은 엑소좀 양을 사용해야 한다.
기존 세포치료제 분야에서 사용되었던 유세포분석기(Flow cytometry)는 500nm 이상의 크기만 분석이 가능하여 엑소좀을 분석하기에는 한계가 있다. 이를 극복하기 위해, 5um 또는 9um 정도의 bead에 엑소좀 표면에 발현하는 분자를 포집(capture)할 수 하는 항체를 결합시켜 유세포 분석기로 분석하는 방법들이 고안되고 있으나 이질성이 높은 엑소좀을 분석하기에는 한계점이 있다.
④ 분석방법의 개발로 단일 엑소좀의 분석이 가능해지고 있다
현재에는 나노 사이즈의 입자를 분석할 수 있는 nano-flow cytometry 통해 엑소좀의 절대 정량이 가능하고 단일 엑소좀을 분석할 수 있게 되었다. 위에서 설명한 NTA를 이용한 입자 수와 nano-flow cytometry에서 측정된 입자 수는 상당한 차이를 보인다. 단일 엑소좀 분석은 엑소좀의 정량 정성 분석이 가능하므로 치료제 개발시 필요한 장비다. 그러나 고가의 장비이며 국내에 장비를 보유한 기관이 거의 없는 등의 여건으로, 아직은 이 기기를 이용한 분석 데이터들이 많이 공유되고 연구되지 않고 있는 실정이다. 따라서 nano-flow cytometry를 이용하여, 엑소좀에 맞는 분석법들을 세팅하고 밸리데이션 하는데 많은 노력과 분석데이터의 축척이 필요할 것으로 생각된다.
⑤ 분리방법과 분석기술의 한계를 극복하기 위한 노력이 필요해
위에 나열한 것처럼 엑소좀 치료제의 배치별 결과값의 차이(variation)를 최소화하고, 엑소좀의 제품품질(QC, Quality control) 관리 기준을 확립하는데 큰 어려움이 있다. 국내 허가기관에서도 이러한 부분들의 우려(한계)를 임상 진입에 큰 어려움으로 인식하고 있다. 다양하게 존재하는 엑소좀 유형들(subtype)을 nano-flow cytometry로 분석이 가능하더라도 엑소좀의 이질성을 어떻게 관리할 것인가도 중요한 숙제로 남아 있다. 따라서 엑소좀 치료제 개발자들은 분리 방법과 분석법의 한계를 인정하고 얼마나 합리적으로 밸리데이션이 가능한 방법들을 수집하고 이에 따른 데이터들을 만들어 제품 공정 및 품질관리(CMC, chemistry manufacturing and controls)를 확립해 허가 기관을 설득시키는 것이 우리가 해야 할 일이라 생각한다.
맺음말

엑소좀은 현재 세포치료제 시장의 상당 부분을 대체할 수 있을 정도로 매력적인 차세대 치료제로 주목받고 있다. 일리아스바이오와 브렉소젠이 해외에서 임상 승인을 받는 등 우리나라의 엑소좀 신약개발 기술력은 세계적인 수준으로 평가받고 있다. 많은 연구자들이 국내에서도 임상 승인 사례가 발표되며 의미 있는 임상결과가 도출되기를 기대하고 있다. 2021년 엑소좀산업협의회가 출범하며 엑소좀 산업 분야의 발전을 논의할 수 있는 자리가 마련되었다. 급성장하고 있는 엑소좀 연구 및 개발에서 공정 개발 및 품질 관리는 임상 개발과 인허가를 위해 매우 중요한 성공 요소임을 거듭 강조한다.

