세계는 지금 |
박동영 DSC/슈미트 바이오팀 심사역
"아벡마, 초기 다발성골수종 임상 순항"

2월 주목할 만한 글로벌 항암제 뉴스
길리어드(Gilead)의 Trop2 ADC(Antibody-Drug Conjugate, 항체약물접합체) 트로델비(성분명 사시투주맙 고비테칸)가 전이성 삼중음성유방암, 전이성 요로상피세포암에 이어 적응증 확장에 성공했다.
길리어드는 이달 3일 트로델비(Trodelvy)가 HR+/HER2-(IHC 0, IHC 1+, IHC 2+/ISH-) 전이성 유방암 환자를 대상으로 FDA의 허가를 받았다고 밝혔다.
이번 허가는 절제가 불가능한 국소 진행성 또는 전이성 HR+/HER2- 유방암 환자를 대상으로 한 TROPiCS-02 임상 3상 결과에 기반했다. 임상에 참여한 환자들은 내분비요법(Endocrine Therapy)을 처방 받은 경험이 있고, 적어도 2번 이상 추가적인 전신 요법(Systemic Therapy)을 받은 환자들이었다. 임상 결과를 보면, 트로델비가 화학항암제 단독투여와 비교해 mOS(Median Overall Survival)와 mPFS(Median Progression Free Survival)를 개선시키는 긍정적인 결과였다.
지난해 트로델비의 초기 결과가 발표될 당시 많은 논란들이 있었다. 트로델비가 화학항암제와 비교해 mPFS를 개선했으나 수치적으로는 약 1.5개월만 늘려 큰 차이가 없어보였다. 그러나 이후 트로델비는 화학항암제 대비 mOS를 약 3.2개월 늘리는 기대 이상의 결과를 발표하면서 이번 허가에 발판을 마련할 수 있었다.
이번 허가에도 불구하고 길리어드 입장에서 보면 몇 가지 우려할 만한 점들이 남아있다. 첫째, 트로델비의 포지셔닝에 대한 이슈다. HER2 ADC 엔허투(성분명 트라스투주맙데룩스테칸)는 HER2 발현이 낮은(HER2-low) 전이성 유방암 환자를 대상으로 FDA의 허가를 받았다. HER2-low는 HER2 IHC 1+, IHC 2+/ISH- 환자이며, 기존 HER2- 환자의 약 65%를 차지한다고 알려졌다.
직접적인 비교는 어렵겠지만, HR+/HER2-low 유방암 환자를 대상으로 한 임상 분석 결과를 보면 엔허투(Enhertu)가 트로델비보다 임상학적 이점이 더 높았다. 엔허투는 화학항암제와 비교해 mPFS를 약 4.7개월 늘렸으나(10.1개월 vs 5.4개월, HR=0.51), 트로델비는 약 2.2개월만 늘렸다(6.4개월 vs 4.2개월, HR=0.58). 트로델비가 HER2를 아예 발현하지 않는(HER2 IHC 0) 환자를 대상으로만 처방될 것인지, 기존 예상하던 환자의 약 3분의 2에 사용하지 못하게 됨에 따라 얼마나 유의미한 매출 증가가 발생할지에 대한 의문이 생긴다.
둘째, 트로델비의 가장 유력한 경쟁약물로 아스트라제네카(Astrazeneca)와 다이이찌산쿄(Daiichi Sankyo)가 공동개발 중인 Trop2 ADC 'Dato-Dxd(Datopotamab Deruxtecan)'가 있다. 지난해 12월 Dato-Dxd는 HR+/HER2 low, HR+/HER2- 유방암 환자를 대상으로 한 초기 임상에서 긍정적인 결과를 발표했다. 공개한 결과에 따르면, mPFS는 8.3개월이었고, mDoR(Median Duration of Response)과 mOS에는 아직 도달하지 않았다.
이번에도 직접적인 비교는 어렵겠지만, Dato-Dxd가 트로델비보다 우수한 효능을 가진 것으로 생각된다. 또한, Dato-Dxd는 전이성 삼중음성유방암 환자 대상 단독투여 또는 더발루맙(Durvalumab)과의 병용투여 임상에서도 긍정적인 결과를 발표했다. 트로델비가 후발주자인 Dato-Dxd 대비 어떤 차별성을 가질 수 있을지는 길리어드의 여전한 숙제로 남아있다.
BCMA CAR-T 아벡마..."더 초기 다발성골수종 치료제로"
BMS의 BCMA CAR-T 아벡마(Abecma)가 다발성골수종(Multiple Myeloma) 환자를 대상으로 한 초기 치료제 임상에서 긍정적인 결과를 발표했다. 이번 임상은 이전에 2~4번 치료를 받은 경험이 있는 재발성 또는 불응성 다발성골수종 환자를 대상으로 아벡마와 표준치료제(Standard of Care, SoC)의 효능을 비교하는 임상이었다. 결과를 보면 아벡마는 SoC와 비교해 mPFS를 개선시켰으며(13.3개월 vs 4.4개월, HR=0.49, p<0.001), CR(Complete Response) 비율도 더 높았다(39% vs 5%).
경쟁약물인 얀센(Janssen)의 BCMA CAR-T 카빅티(Carvykti)도 지난달 이전에 1~3번 치료를 받은 경험이 있는 재발성 또는 레날리도마이드(Lenalidomide) 불응성 다발성골수종 환자를 대상으로 한 초기 치료제 임상에서 긍정적인 결과를 발표했다. 얀센이 아직 자세한 임상 결과는 공개하지 않아 이번 BMS의 임상과 비교하기에는 어려움이 있다. 그러나 카빅티는 아벡마와 비교해 좀 더 초기치료제 임상에 집중했으며, 아벡마는 Triple-class-exposed 다발성골수종 환자에 더 초점을 맞추고 있는 것처럼 보인다.
BMS는 이번 임상 참여자의 약 66%가 Triple-class-exposed 다발성골수종 환자였다고 설명했다. Triple-class-exposed 다발성골수종 환자들은 Immunomodulatory Drug(Thalidomide, Lenalidomide, Pomalidomide), Proteasome Inhibitor(Bortezomib, Carfilzomib, Ixazomib), anti-CD38 Monoclonal Antibody(Daratumumab) 등을 모두 처방 받은 경험이 있으며, 이러한 환자들의 경우 마땅한 치료 옵션이 없고 예후가 좋지 않다고 알려졌다.
현재 BCMA 타깃 치료제들의 개발 경쟁이 치열하다. BCMA CAR-T인 아벡마와 카빅티 외에도 얀센의 BCMAxCD3 이중항체 테크베일리(Tecvayli, 성분명 테클리스타맙)가 지난해 10월 FDA의 허가를 받았다. 테크베일리의 경쟁 약물로 화이자(Pfizer)의 엘라나타맙(Elranatamab)이 있으며, 화이자는 최근 오릭 파마슈티컬스(ORIC Pharmaceuticals)의 CD73 타깃 저분자화합물 'ORIC-533'과 엘라나타맙의 병용투여 임상을 진행할 계획이라고 언급한 바 있다.
이렇게 치열한 경쟁 속에서 암젠(Amgen)은 BCMAxCD3 BiTE(Bispecific T-cell Engager) 'Pavurutamab'의 개발을 중단한다고 발표했으며, GSK의 BCMA ADC 'Blenrep'은 확증 임상(Confirmatory Trial)에서 1차 충족점인 PFS를 개선시키지 못해 경쟁 시장에서 떠나게 됐다.
바이시클 테라퓨틱스, 'Nectin-4 BTC' 요로상피세포암 1상 긍정적
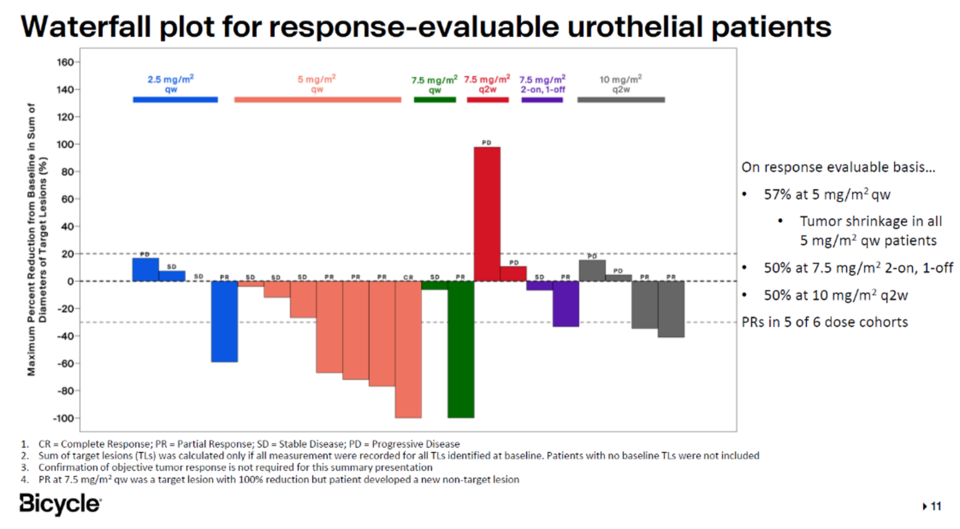
바이시클 테라퓨틱스(Bicycle Therapeutics)가 개발 중인 Nectin-4 타깃 BTC(Bicycle Toxin Conjugate) 'BT8009'가 요로상피세포암(Urothelial Cancer) 환자를 대상으로 한 임상 1상에서 긍정적인 결과를 발표했다. BTC는 ADC와 유사한 콘셉트의 약물이나 항체가 아닌 이중고리 구조 펩타이드(Bicyclic Peptide)에 세포독성제(Cytotoxic Agent)가 결합된 형태다. 회사 측은 이중고리 구조 펩타이드는 항체와 비교해 타깃 특이성과 결합력이 높고, 크기가 작아 조직 내 침투성이 높다고 설명했다. 또한, 체내에서 제거되는 속도가 빨라 전신에 노출되는 시간이 짧고, 그로 인해 독성이 낮다는 장점도 가지고 있다고 부연했다.
BT8009는 Nectin-4 특이적인 이중고리 구조 펩타이드에 세포독성제 MMAE(Monomethyl Auristatin E)가 결합된 약물이며, 요로상피세포암을 포함한 다양한 고형암 환자를 대상으로 한 임상 1상을 진행했다. 요로상피세포암 환자 24명을 대상으로 분석한 결과를 보면, ORR(Overall Response Rate)이 38%였다. 임상 2상 권장용량(Recommended Phase 2 Dose, RP2D)을 투여 받은 그룹에서만 보면 ORR이 50%였고, mDoR에는 아직 도달하지 않았다.
경쟁물로는 아스텔라스(Astellas)와 씨젠(Seagen)이 개발한 Nectin-4 ADC 'Enfortumab Vedotin(Padcev)'이 있다. 엔포투맙 베도틴(Enfortumab Vedotin)은 PD-1/L1 면역항암제, 백금 기반 화학항암제(Platinum-based Chemotherapy)를 이전에 처방 받은 경험이 있는 국소 진행성 또는 전이성 요로상피세포암 환자를 대상으로 한 임상을 진행했으며, ORR 44%, mDoR 7.6개월이었다.
바이시클 테라퓨틱스는 엔포투맙 베도틴과 비교해 BT8009가 우수한 안전성 프로파일(Safety Profile)을 보였다고 강조했다. 직접적인 비교는 어렵겠지만, BT8009는 엔포투맙 베도틴과 비교해 3등급 이상의 발진(Rash) 발생 비율이 더 낮았다. 또한, 엔포투맙 베도틴 임상 중단의 주요 원인인 말초신경병증(Peripheral Neuropathy) 발생 비율도 BT8009 임상에서 더 낮았다.
최근 코버스 파마슈티컬스(Corbus Pharmaceuticals)도 CSPC Megalith Biopharmaceuticals로부터 Nectin-4 ADC 'CRB-701'을 라이선스인(License-in) 했다고 발표했다. 현재 CRB-701은 중국에서 고형암 환자를 대상으로 한 용량 증가(Dose Escalation) 임상 1상을 진행 중이며, 코버스 파마슈티컬스는 내년 미국 내 임상 1상 진입을 목표로 하고 있다.
라바 테라퓨틱스, 'PSMAxγδT세포 이중항체' 전립선암 1/2a상 DCR 57%

감마델타T세포(γδT) 타깃 이중항체 개발 기업인 라바 테라퓨틱스(Lava Therapeutics)가 전이성 거세저항성 전립선암(Metastatic Castration-resistant Prostate Cancer, mCRPC) 환자를 대상으로 한 'LAVA-1207'의 임상 1/2a상에서 다소 실망스러운 결과를 발표했으며, 최근 5일 동안 주가는 약 30% 이상 하락했다. LAVA-1207은 전립선암에서 과발현한다고 알려진 PSMA(Prostate-Specific Membrane Antigen)와 γδT에 결합할 수 있는 이중항체다. 공개한 임상 결과를 보면, DCR(Disease Control Rate)이 57%였다. 라바 테라퓨틱스는 2등급 이상의 사이토카인 방출 증후군(Cytokine Release Syndrome, CRS) 및 용량제한독성(Dose Limiting Toxicity, DLT)은 보고되지 않았다고 설명했다.
최근 γδT에 대한 관심이 높아졌으며, 많은 투자 및 관련 딜이 일어났다. γδT 타깃 항체 개발 기업 ImCheck Therapeutics는 지난해 화이자, 웰링턴 파트너스(Wellington Partners)로부터 약 1억100만 달러의 투자를 유치했으며, 씨젠(Seagen)은 라바 테라퓨틱스의 γδT 인게이저(Engager) 'LAVA-1223'을 인수했다. 더 나아가 다케다(Takeda)는 γδT 기반 세포치료제 개발 기업인 감마델타 테라퓨틱스(GammaDelta Therapeutics)와 어댑테이트 바이오테라퓨틱스(Adaptate Biotherapeutics)를 모두 인수했다.
고형암 치료에 있어 γδT가 흥미로운 타깃인 것은 맞으나 아직 모르는 것이 많은 것처럼 보인다. γδT 중 어느 서브타입(Subtype)이 고형암 치료에 더 적합한지(Vδ1 vs Vδ2 vs Vδ3), 암 종 또는 타깃에 따라 적합한 모달리티에 차이가 있는지(γδT 기반 세포치료제 vs γδT 타깃 단일항체 vs γδT 타깃 이중항체), γδT의 높은 세포 가소성(Cell Plasticity)은 어떻게 극복할 것인지, γδT 기반 신약과 면역항암제의 병용투여는 성공 가능성이 있는지 등에 대한 해답이 필요할 것으로 생각된다.

박동영 DSC/슈미트 바이오팀 심사역은...
2021년 5월부터 DSC/슈미트 바이오팀에서 일하고 있는 박동영 심사역은 2015년 경희대 유전공학과를 졸업한 뒤 2016년 10월 포항공과대학교 융합생명공학부에서 '암 저산소증과 해당작용에 있어서의 대식세포의 역할 규명' 주제의 논문으로 석사학위를 받았다. 2020년 3월부터 8월까지 미국 텍사스 소재 Baylor College of Medicine에서 연구원으로 일하며 '대장암과 마이크로바이옴과의 관계 규명'을 연구했다. 한때 바이오스펙테이터 기자로도 일했다.

