EMA, LAPSTripleAgonist '특발성 폐 섬유증' 적응증 추가 지정
"FDA 9건, EMA 8건, 식약처 3건 등 국내제약사 중 최다 기록 자체 경신"

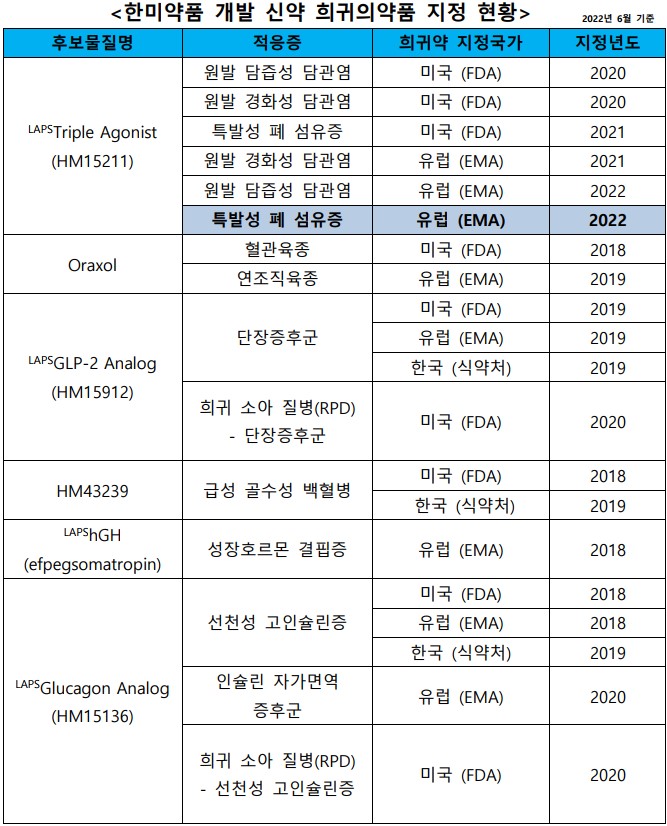
한미약품이 개발 중인 혁신신약들의 한국·미국·유럽 규제기관 희귀의약품 지정 건수가 20건으로 확대돼 국내 제약바이오 기업 최다 지정 기록을 자체 경신했다. 한미약품은 6개 파이프라인 내 10가지 적응증으로 △미국 FDA 9건 △EMA 8건 △한국 식약처 3건의 희귀의약품 지정 기록을 보유하게 됐다.
이번 기록 경신은 최근 유럽의약품청(EMA)이 한미약품(대표 권세창, 우종수)의 삼중작용 바이오신약 'LAPSTripleAgonist(랩스트리플아고니스트, HM15211)'를 '특발성 폐 섬유증(IPF, Idiopathic Pulmonary Fibrosis)' 치료를 위한 희귀의약품으로 추가 지정함에 따른 것으로 확인됐다. '특발성 폐 섬유증'은 원인을 알 수 없는 폐 염증 과정 및 섬유세포 과증식으로 나타난 조직 섬유화로 인해 폐기능이 급격히 떨어지면서 사망할 수 있는 희귀질환이다.
LAPSTriple Agonist는 GLP-1 수용체, 글루카곤 수용체 및 GIP 수용체를 동시에 활성화하는 삼중작용제로 △섬유화를 억제하는 '글루카곤' △인슐린분비 및 식욕억제를 돕는 'GLP-1' △인슐린분비 및 항염증 작용의 'GIP'를 동시에 타겟하는 삼중작용 신약이다. 회사 측은 특발성 폐 섬유증 동물모델에서 LAPSTriple Agonist의 항염증·항섬유화 효과를 확인한 바 있다.
이 약물은 현재 FDA와 EMA로부터 각각 △원발 담즙성 담관염 △원발 경화성 담관염 △특발성 폐 섬유증 적응증으로 총 6건의 희귀의약품 지정을 보유하고 있다.
권세창 사장은 "삼중작용 바이오신약 LAPSTriple Agonist가 주요 적응증인 비알코올성 지방간염(NASH)은 물론, 섬유화를 일으키는 다양한 희귀질환의 적응증에서도 유의미한 잠재력을 계속 확보해나가고 있다"며 "희귀질환으로 고통받는 환자들의 삶의 질 향상을 위해 LAPSTriple Agonist 개발과 상용화에 최선을 다하겠다"고 말했다.
한편, FDA와 EMA는 희귀·난치성 질병 또는 생명을 위협하는 질병의 치료제 개발 및 허가가 원활히 이뤄질 수 있도록 지원하기 위해 '희귀의약품 지정' 제도를 운영하고 있다. 유럽의 경우 허가신청 비용 감면, 동일계열 제품 중 최초 시판허가 승인 시 10년간 독점권 등 혜택이 부여된다.