PV 조직·SOP·RMP·정보보고·신속보고 등 점검기준 제시
업계 "강제성 없지만, 체크리스트 반영 SOP 변경 고려"

식품의약품안전처가 의약품 제조업체의 안전성 정보보고관리 자체점검 지원 방안으로 '안전정보 관리 자율점검 체크리스트'를 배포한 것과 관련, 제약업계는 이 조치가 자율성을 강조했다기 보다 사실상 추후 PV(Pharmacovigilance, 약물감시) 실사 검토기준을 미리 규정한 것으로 받아들이고 있다.
이인선 식약처 의약품안전평가과 사무관은 지난 7일 안전성 정보 보고 정책 설명회에서 "의약품 제조업체들이 '수집절차 미비' 등으로 인한 보고 누락이 없도록, 업체의 자발적 부작용 보고 강화 마련을 위해 '자율점검 체크리스트'를 제약 관련 협회 등을 통해 배포할 것"이라고 알린 바 있다.
식약처의 자율점검 체크리스트 배포는 현재 업체들의 자발적인 PV 자율점검에 대한 주기, 검토 항목 등이 없는 상황에 별도의 기준을 제시하기 위함으로 해석된다.
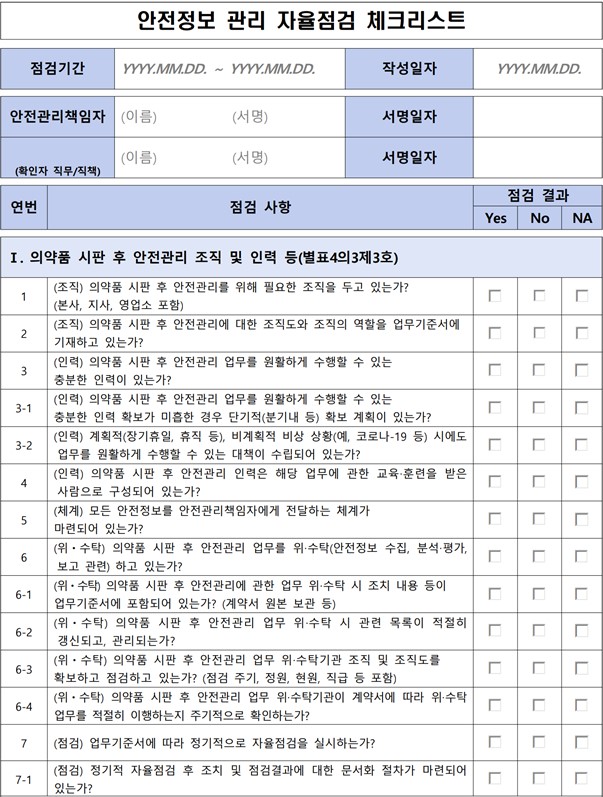
이 체크리스트를 통해 업체들은 자율적으로 점검 사항들을 △Yes △No △NA(해당사항 없음)로 체크해 관리할 수 있다.
점검사항을 구체적으로 살펴보면 △의약품 시판 후 안전관리 조직 및 인력 등(별표4의3제3호) △업무기준서(SOP)(별표4의3제4호) 관리 및 운영 △위해성 관리 계획(RMP) 제출에 따른 안전관리(별표4의3제5호) △안전성정보의 보고(별표4의3제6호) △안전성정보의 신속보고 등(별표4의3제7호)의 분류로 나뉜다.
식약처는 자율점검 체크리스트 자체에 강제성을 부여하고 있지 않지만, 업체 입장에서는 사실상 추후 PV실사 기준으로 작용할 수 있기 때문에 무시할 수 없다는 입장이다.
한 중견 제약사 PV 담당자는 "식약처 입장에서는 업계에서 의약품 부작용이 발생했을 시 신속 보고를 해야 하는 등 법규에 따른 대처가 시행되야 하는데, 미비된 경우가 종종 발생하고 있어 업계의 기반을 다지기 위한 가이드를 제시하고자 하는 취지였을 것"이라며 "다만, 제약사 입장에서 봤을 땐 이번 체크리스트 검토사항을 추후 PV 실사기준으로 삼을 것임을 미리 공개한 것 아닌가라는 생각이 든다"고 말했다.
이어 "기존에 보유하고 있던 SOP를 해당 체크리스트에 맞게 다 수정을 해야할 지 고민하고 있다"며 "이 부분은 추가적인 인력과 시간이 필요한 부분이기 때문에 내부적으로 수정 여부를 논의 중에 있다"고 설명했다.
즉, 식약처가 이런 가이드를 제시한 데는 추후 심사에 활용하겠다는 의중이 녹아 있을 것이기 때문에 이에 맞춰 내부 SOP 변경을 고려하고 있다는 것이다.
또 다른 약물감시 관계자는 "식약처는 설명회를 통해 해당 체크리스트를 참고로 해 업체 상황에 맞춰 일부 가감이 가능하다고 소개했으나, 오히려 이 부분에서 어느 정도 반영해야 될지 애매해졌고, 섣불리 SOP를 변경하기 부담스러워졌다"며 "구체적인 시행날짜 또한 제시되지 않아 언제부터 이 체크리스트를 통해 점검을 실시해야 할지도 불투명하다"고 말했다.

