KTB투자증권 등 애널리스트들 분석
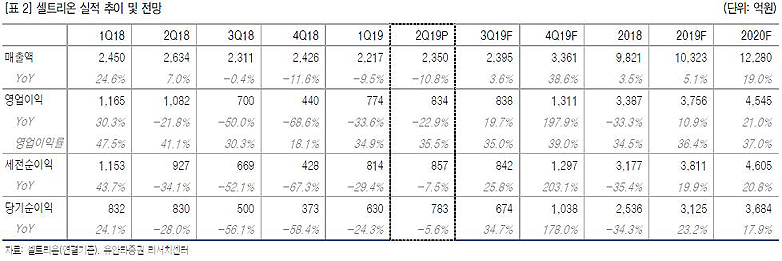
2분기 매출 2350억원·영업이익 834억원

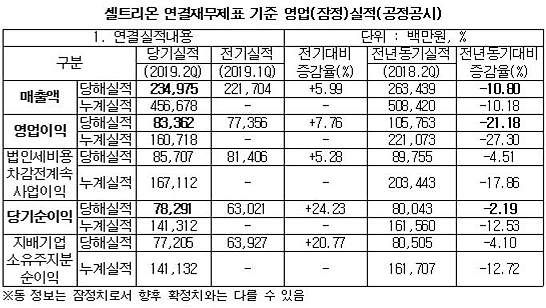
상반기 매출 4567억원(전년동기 대비 -10.18%)을 기록한 셀트리온이 올 하반기 큰 폭의 성장을 예고하고 있다. 램시마·트룩시마·허쥬마의 견고한 매출을 기반으로 후속 바이오시밀러 개발이 한참 진행 중이며, 올 연말부터는 램시마SC의 유럽 허가와 트룩시마·허쥬마의 미국 출시도 예정돼 있기 때문이다.
강하영·이혜린(KTB투자증권)·서미화(유안타증권) 애널리스트는 2일 기업분석 보고서를 통해 셀트리온의 하반기 실적을 이 같이 전망했다.
금융감독원에 따르면, 셀트리온은 연결재무제표 기준으로 2분기 매출액 2350억원·영업이익 834억원·순이익 783억원을 기록했다. 이는 1분기 대비 각각 6%·7.8%·24.2% 증가한 수치다.
현재 램시마는 한국·유럽·미국 등 80개국, 트룩시마·허쥬마는 한국·유럽 등지에서 판매되고 있다. 아이큐비아(IQVIA) 자료를 보면, 올해 1분기 유럽 시장점유율은 램시마 57%·트룩시마 37%·허쥬마 13%로 성장세를 이어가는 중이다.
또 정맥주사 제형인 램시마를 피하주사로 변경한 램시마SC는 유럽의약품청(EMA)의 판매허가 승인을 앞두고 있으며, 미국 임상 3상도 진행 중이다. 셀트리온은 초기 램시마를 투여해 약효를 높이고 유지 치료 시 램시마SC를 투여하는 방식의 병행 치료를 통해 극대화된 치료 효과를 기대하고 있다.
서미화 애널리스트는 "램시마SC는 유럽 올 4분기, 미국 2022년 승인이 예상된다"며, "기존 병원에서 2시간 투여하던 정맥주사 제형을 2분간 집에서 투여 가능하도록 제형을 변경해 편의성을 증대한 제품으로 신규환자 유입뿐 아니라 기존 환자 이탈도 방지할 수 있다는 점에서 그 가치가 높다"고 했다.
지난해 11월과 12월 미국 FDA 허가를 받은 혈액암·유방암 치료제 트룩시마·허쥬마는 올 4분기와 내년 1분기 미국 출시를 기다리는 중이다. 대장암 치료제 'CT-P16'과 자가면역질환 치료제 'CT-P17'은 글로벌 임상 3상을 진행 중이며, 알러지성 천식·만성 두드러기 치료제 'CT-P39'는 2024년 초 허가를 목표로 임상 1상에 본격 돌입한다.
셀트리온은 "이 외 15개 이상의 후속 바이오시밀러 제품군의 세포주·공정 개발을 진행하고 있다"며, "2030년까지 해마다 1개의 바이오시밀러 제품을 출시할 계획"이라고 했다.
강하영·이혜린 애널리스트는 "램시마SC 유럽 허가와 트룩시마·허쥬마 미국 출시에 따른 초도 물량 공급으로 올 하반기에는 매출액 69%·영업이익 167%의 고성장이 전망된다. 셀트리온의 위탁 생산제품인 테바의 편두통 신약 '아조비'도 하반기에는 매출이 발생할 것으로 보인다"고 내다봤다.