알바이오 이달초 재신청... 허가 결과, 가을 무렵 예상
지난 중앙 약심의 반려 결정엔 논의의 여지 있어
"보완 자료상 효능, 통계적·임상적 유의성 충족"
네이처셀의 관계사 알바이오가 줄기세포 치료제 '조인트스템'의 품목허가를 이달 초에 재신청했습니다. 2021년 식품의약품안전처에 처음으로 허가 신청을 한 지 3년 만입니다. 그리고 작년 4월에 허가 신청이 반려된 지로는 1년 만이죠.
작년에 조인트스템의 허가 신청이 반려됐을 때, 제약바이오 업계는 크게 술렁였습니다. 그도 그럴 것이, 반려 사유가 '통계적 유의성은 있지만 임상적 유의성은 없다'였기 때문입니다. 적지 않은 이들이 '이것이 반려 사유가 될 수 있나'라며 고개를 갸웃거리게 만들었던 사건인데요. 어떤 이야기인지 되짚어볼 필요가 있군요.
그리고 허가 재신청이 이뤄졌으니, 심기일전한 알바이오가 들고 나온 새로운 데이터가 어떤지도 살펴야겠습니다. 이번엔 허가 가능성이 얼마나 될지 가늠해볼 수 있을 겁니다.
조인트스템의 허가가 반려됐던 이유
조인트스템은 무릎 퇴행성 관절염에 대한 치료제입니다. 따라서 조인트스템이 목표로 하는 효능은 '무릎 통증을 줄여줘서 잘 걷게 만드는 것'이라 할 수 있습니다.
이런 효능을 입증하기 위해 알바이오는 조인트스템의 임상 3상 시험에서 관절 기능ㆍ통증을 평가하는 지표인 'WOMAC'과 통증을 평가하는 'VAS' 지수를 사용했습니다. 조인트스템을 주사하기 전에 WOMACㆍVAS 점수를 잰 다음, 주사한 후 6개월 뒤에 다시 WOMACㆍVAS 점수를 잰 것이죠. 결과적으로 조인트스템 주사 전후의 점수차가 뚜렷이 나타났고, 그 차이는 통계적으로도 의미가 있었습니다.

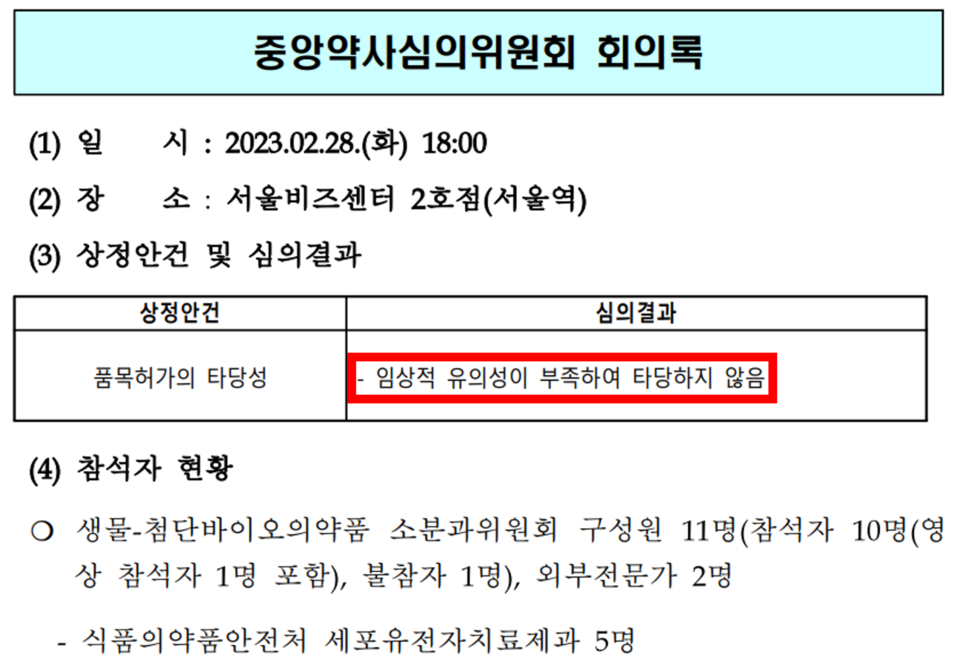
알바이오는 2021년에 이런 결과를 근거로 식약처에 품목허가를 신청했습니다. 그래서 식약처는 검토를 위해 중앙약사심의위원회(중앙 약심)를 열었고, 1차 회의에선 조인트스템이 통계적으로도, 임상적으로도 유의했다는 결론을 내게 됩니다. 그런데 2차 회의에선 '통계적으로는 유의했지만, 임상적으로는 유의하지 않았다'며 의견이 번복돼 허가 불발로 이어졌던 겁니다.
'임상적으로 유의하지 않았다'는 것이 무엇인지 궁금해지는 부분입니다. 2차 중앙약심의 회의록을 찾아보니, 고혈압 치료제를 예로 든 설명이 있습니다. 고혈압 신약이 환자의 혈압을 5mmHg 낮추는 효과가 있고, 이것이 통계적으로 유의했다고 상상해 봅시다. 그런데 고혈압으로 인한 증상ㆍ불편함을 실제로 개선하려면 최소 20mmHg는 낮아져야 한다면요? 혈압 5mmHg 감소가 통계적으로 유의했다 한들, 환자가 이 신약을 먹어도 증상 개선은 없을 겁니다. 이것이 임상적으로 유의하지 않다는 표현의 의미입니다.
이제 조인트스템으로 돌아오겠습니다. 중앙약심 2차 회의에서 제기된 문제가 '임상적으로 유의하지 않음'이었으니, 임상적으로 유의한 WOMACㆍVAS 점수가 따로 있고, 조인트스템의 점수는 여기 미치치 못했을 거라는 추측이 가능합니다. 그런데 이 추측은 틀렸습니다. 중앙약심에 임상적으로 유의한 WOMACㆍVAS 점수가 따로 마련돼 있었던 것도 아니고, 2차 회의 중 위원들이 그런 점수를 제시한 것도 아니었으니까요.
이런 기준을 어렵게 말하면 'MCID(minimal clinically important difference)'라 합니다. '임상적인 의미가 있다'고 할 수 있는 최소한의 효과의 크기입니다. 예컨대 중앙약심이 '무릎 퇴행성 관절염 치료제의 MCID는 WOMAC XX점, VAS XX점이고, 이 점수를 못 넘으면 허가를 반려하겠다'고 정해뒀거나, 2차 회의에 참석했던 전문가가 MCID를 명확히 이야기했다면 모든 게 괜찮았을 겁니다.
문제는 2차 회의에서 MCID 이야기가 나오는가 싶더니 '딴 길'로 샜다는 것입니다. 알바이오는 임상 3상 시험을 진행하면서 조인트스템이 보일 것으로 예상되는 주사 전후 WOMACㆍVAS 점수차를 설정해 뒀는데요. 각각 15점ㆍ20점이었습니다. 그런데 중앙약심 2차 회의의 위원들은 이 점수를 MCID로 생각하고 조인트스템을 평가합니다. 그리고 임상 3상의 WOMACㆍVAS 결과가 MCID에 미치지 못했다며 허가 거절 의견을 냅니다.
비유하자면 학교에서 시험을 치기 전에 내가 '100점을 받을 것 같다'고 예상을 했는데, 시험 점수가 90점이 나오자 선생님이 '네가 100점을 받겠다고 예상했는데 90점을 받았으니 낙제시키겠다'고 말하는 겁니다. 사전에 평가 기준이 마련돼 있는 게 아니라, 시험을 친 내가 예상한 점수를 기준으로 성적을 주는 것이죠. 분명 정상적인 상황이라고 보기는 어렵습니다.
이어 회의록에선 '조인트스템의 작용기전을 보니, 항염증 작용ㆍ윤활작용에 있어 덱사메타손과 히알루론산이 더 나을 듯하다'는 발언이 등장합니다. 또 '줄기세포 치료제라면 재생 효과가 있어야 하는데, 통증 개선 효과만 있다', '이 정도로는 인공관절치환술을 줄일 수 없다'는 식의 표현도 나옵니다.
하지만 작용기전에 대한 이야기는 수치를 근거로 든 게 아니라 추측입니다. 또 '줄기세포 치료제가 꼭 재생 효과를 보여야 한다'는 건 허가에 필요한 기준이 아닙니다. 인공관절치환술을 줄일 수 없다는 의견도 추측이죠. 조인트스템의 허가가 반려됐을 때 곳곳에서 중앙약심에 대한 비판이 일었던 배경이 바로 이것입니다.
아무튼 시간은 흘러 알바이오는 조인트스템 허가에 다시 도전했습니다. 어떤 자료를 준비했고, 어떤 결과가 나올까요? 알바이오가 제출한 보완자료를 보겠습니다.
허가 재신청 보완 자료의 핵심 내용은
상술했듯 알바이오가 조인트스템 허가를 처음 신청했던 때가 2021년입니다. 이후 3년 동안 회사는 이 시간을 활용해 효능 데이터를 축적했습니다. 즉 기존 임상 3상 시험의 3년 장기추적관찰 결과가 이번 허가 재신청을 뒷받침하게 됩니다.
이 3년치의 데이터가 가지는 의미를 이해하려면, 무릎 퇴행성 관절염 치료가 원래는 어떻게 이뤄지는지 알아야 합니다. 현재로서는 무릎 퇴행성 관절염 치료법으로 소염진통제(NSAIDs)ㆍ스테로이드 주사ㆍ히알루론산 주사ㆍ인공관절치환술이 시행되고 있습니다. 중증(K-L grade 3)에 해당하는 환자들은 소염진통제ㆍ스테로이드ㆍ히알루론산을 투여받다가, 적지 않은 경우 결국 인공관절치환술을 받게 됩니다.
이들 요법에는 한계가 있습니다. 소염진통제는 통증 경감 효과가 하루 정도면 끝납니다. 스테로이드 주사는 최대 3개월 정도지만, 부작용 때문에 지속 투여가 힘듭니다. 히알루론산은 최대 6개월 동안 효과가 지속된다고는 하지만, 임상적 유의성에 의문이 남는 요법입니다.
따라서 조인트스템이 목표로 해야 하는 효능은 '1회 투여로 6개월 이상 통증을 줄이고, 부작용이 덜하며, 그 결과가 통계적ㆍ임상적으로 유의한 것'이 됩니다. 결론부터 말하자면, 이번 허가 재신청에 쓰인 보완자료를 보니 조인트스템은 이 목표를 모두 달성한 것으로 보입니다.
먼저 조인트스템은 1회 투여로 3년간 지속되는 관절 기능 개선ㆍ통증 감소 효과를 보였습니다. 위에서 이야기했던 WOMACㆍVAS 점수를 3년 동안 확인해 보니 투여 6개월 시점부터 개선 효과가 확인되며, 이후 1년ㆍ2년ㆍ3년 시점에서 그 효과가 유지됐습니다. 통계적으로도 유의한 결과였고요.
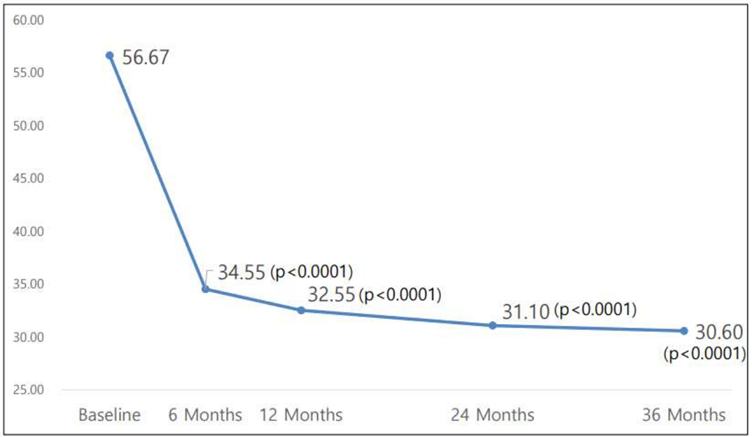
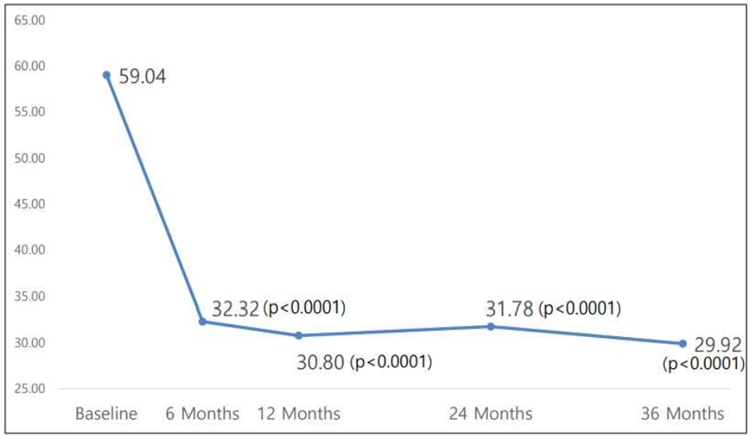
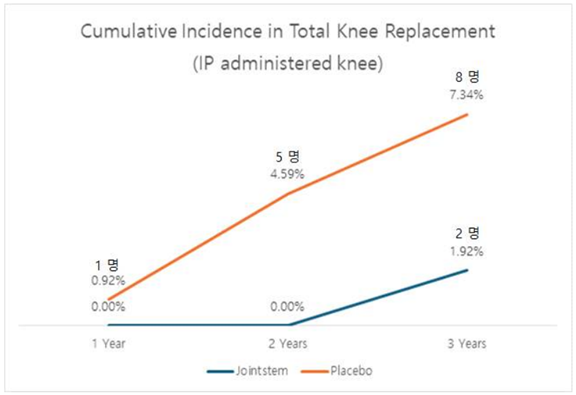
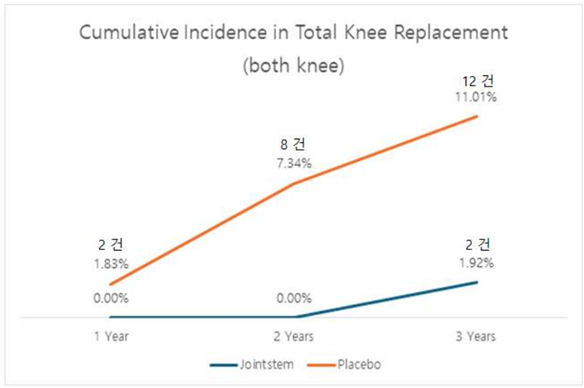
또 위에서 설명했듯 중앙약심 2차 회의에서 '조인트스템으로는 인공관절치환술을 줄이지 못할 것'이라는 발언이 있었습니다. 그래서 이번 허가신청 보완자료에는 조인트스템을 투여받는 환자가 얼마나 인공관절치환술을 덜 받았는지 분석한 결과가 탑재됐는데요. 대조약이 투여된 환자들은 3년차에 8명이 인공관절치환술을 받았던 반면, 조인트스템이 투여된 환자들은 2명이 인공관절치환술을 받았습니다. 다시 말해 조인트스템이 인공관절치환술을 줄일 수 있다는 데이터가 확인된 겁니다.
조인트스템, 이번엔 허가될까
알바이오는 조인트스템 1회 투여가 3년까지 통증을 줄이고, 별다른 약물 부작용이 없으며, 그 결과가 통계적ㆍ임상적으로 유의하다는 것을 3년 장기 추적 결과를 통해 보여줬습니다. 인공관절치환술의 수를 줄일 수 있다는 결과도 곁들여졌습니다. 작년에 허가가 반려되며 제기됐던 사항들이 상당 부분 보완됐고요.
물론 변수는 있습니다. 중앙약심의 입장이 이번엔 어떻게 될지 아직 모릅니다. 중앙약심 2차 회의에서 보여진 MCID 기준에 대한 오해와 정성적인 기준을 두고 빚어진 주관적 해석이 이번에는 해결되기를 바라야겠죠. 즉 무릎 퇴행성 관절염 전문 임상의들이 향후 중앙약심에 대거 참가해 명확한 정량적 기준을 두고 조인트스템을 재평가하는 게 최선일 것으로 보입니다.
조인트스템 품목허가 결정까지는 6개월가량의 여정이 남았습니다. 가을 즈음 관련 이슈로 돌아올 것을 예고하며, 이만 마치겠습니다.

