골관절염 치료제제 세레콕시브에 레일라 복합제 줄이어 허가
PD-L1-ㆍKRAS/p.G12C+ 진행성 비소세포폐암 치료제 임상 3상 돌입
골관절염 천연물 치료제 '레일라(성분 당귀·모과·방풍·속단·오가피·우슬·위령선·육계·진교·천궁·천마·홍화25%에탄올연조엑스(3.5→1), 피엠지제약)'에 세레콕시브 성분을 조합한 복합제 출시가 잇따르고 있다. 지난주(2023년 8월 7일~8월 11일) 식품의약품안전처는 레일라+세레콕시브 복합제 20개 품목을 포함한 39개(전문약 31개, 일반약 8개) 품목을 각각 허가했다.
레일라+세레콕시브 20개 품목 허가…베링거인겔하임 신약 허가


레일라+세레콕시브 복합제는 피엠지제약이 지난 2012년 12월 발매한 천연물 신약인 '레일라'와 관절염 등 만성 질환 염증과 통증을 감소시키는 소염진통제 '세레콕시브' 복합제다. 레일라 개발사인 피엠지제약의 복합제 품목 허가 이후 한 주만에 19개 품목이 허가를 획득했다.
레일라 개발사 한국피엠지제약을 시작으로 한국휴텍스제약, 팜젠사이언스, 알리고제약, 삼일제약, 에이치엘비제약, 대웅바이오, 유니메드제약, 제뉴원사이언스, 동국제약, 일화, 경동제약, 풍림무약, 바스칸바이오제약, 씨엠지제약, 진양제약, 삼진제약, 한국유니온제약, 광동제약, 안국약품 등이 이름을 올렸다.
또 식약처는 제2형 당뇨병 치료 성분인 DDP-4 억제제(DPP-4i)인 시타글립틴인산염수화물(시타글립틴)과 티아졸리딘디온(TZD) 계열 피오글리타존염산염(피오글리타존) 복합제 4개 품목 8개 용량군을 각각 승인했다. 업체는 삼익제약과 한국휴텍스제약, 메디카코리아, 마더스제약 4개사로, 용량군은 시타글립틴/피오글리타존 100/30, 100/15밀리그램으로 동일했다.
베링거인겔하임은 전신 농포성 건선 치료제 '스페비고주(성분 스페솔리맙)' 신약 품목 허가를 획득했다. 전신 농포성 건선(Generalized Pustular Psoriasis·GPP)은 피부와 내부 장기에 영향을 미치는 전신 염증을 특징으로 하는 질환으로, 광범위 홍반·열·호중구 증가증·피부 통증 등 증상을 동반하는 것으로 알려졌다. 허가 사항에 따르면 해당 제품은 성인 환자의 상태가 급격히 악화될 경우 사용할 수 있다.
한국아이큐비아, PD-L1-·KRAS/p,G12C+ 비소세포폐암치료제 3상
한국아이큐비아는 PD-L1 음성, KRAS/p,G12C 양성인 4기, 혹은 진행성 3B/C기 비편평 비소세포폐암 환자를 대상으로 1차 요법으로써 소토라십/백금 이중 병용요법과 펨브롤리주맙/백금 이중 병용요법 유효성을 평가하는 제3상 임상시험을 승인받았다. 다기관, 무작위 배정, 라벨 공개 임상시험(연구명 CodeBreaK 202)으로 설계됐다.
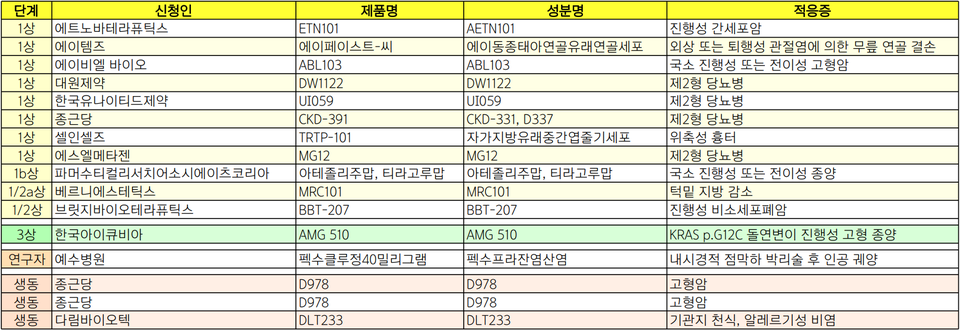
에트노바테라퓨틱스와 브릿지바이오테라휴틱스는 각각 진행성 간세포암, 진행성 비소세포폐암 환자를 대상으로 하는 치료물질 내약성 및 약동학적 특성 평가를 위한 1상 임상시험을 승인받았다.
에트노바테라퓨틱스는 진행성 간세포암 환자를 대상으로 'ETN101(개발코드명)'의 안전성, 내약성 및 약동학적 특성 평가에 나서며, 브릿지바이오테라퓨틱스는 EGFR TKI 치료 후 EGFR 돌연변이가 있는 진행성 비소세포폐암 환자를 대상으로 'BBT-207'에 대한 첫 인체 적용 임상시험에 나설 예정이다.

