14일 '의약품등 품목별 사전 GMP 평가 운영지침' 개정·배포
우선 GMP 평가 시, 선임급 이상 GMP조사관 배정
"비대면, 보완 많고 기간 오래 소요…신약 현장 실사로 빠르게 진행"

의약품 제조소의 사전 GMP 실태조사를 이전 접수 제조소보다 빠르게 받을 수 있도록 하는 '우선 GMP 평가' 제도가 실시된다. 또 사전 GMP 실태조사 대상에 신약 제조소도 추가된다.
23일 식품의약품안전처에 따르면 식약처는 지난 14일 '의약품등 품목별 사전 GMP 평가 운영지침'을 개정·배포했다. 이번 운영지침 개정은 우선 GMP 평가 신설 및 신약 제조소 실태조사 대상 포함 등이 골자다.
운영지침을 살펴보면 '약사법 제35조의4(우선심사 대상 지정)'에 해당하는 의약품 제조소는 식약처에 우선심사 대상으로 지정해 달라고 신청할 수 있다. 우선심사 대상으로 지정되면 우선 사전 GMP 평가가 가능해진다.
대상은 △심각한 중증질환 또는 '희귀질환관리법' 제2조제1호에 따른 희귀질환을 치료하기 위한 목적으로 사용되는 의약품 △'제약산업 육성 및 지원에 관한 특별법' 제2조제3호에 따른 혁신형 제약기업이 개발한 신약 등이다. 이 외 '행정지원 대상 선정 의약품'이 우선 사전 GMP 평가 대상으로 선정될 수 있다.
이 의약품들은 선임 등급 이상 GMP 조사관이 평가자로 배정되며, 기존 평가 중인 품목보다 먼저 실사를 실시할 수 있게 된다.
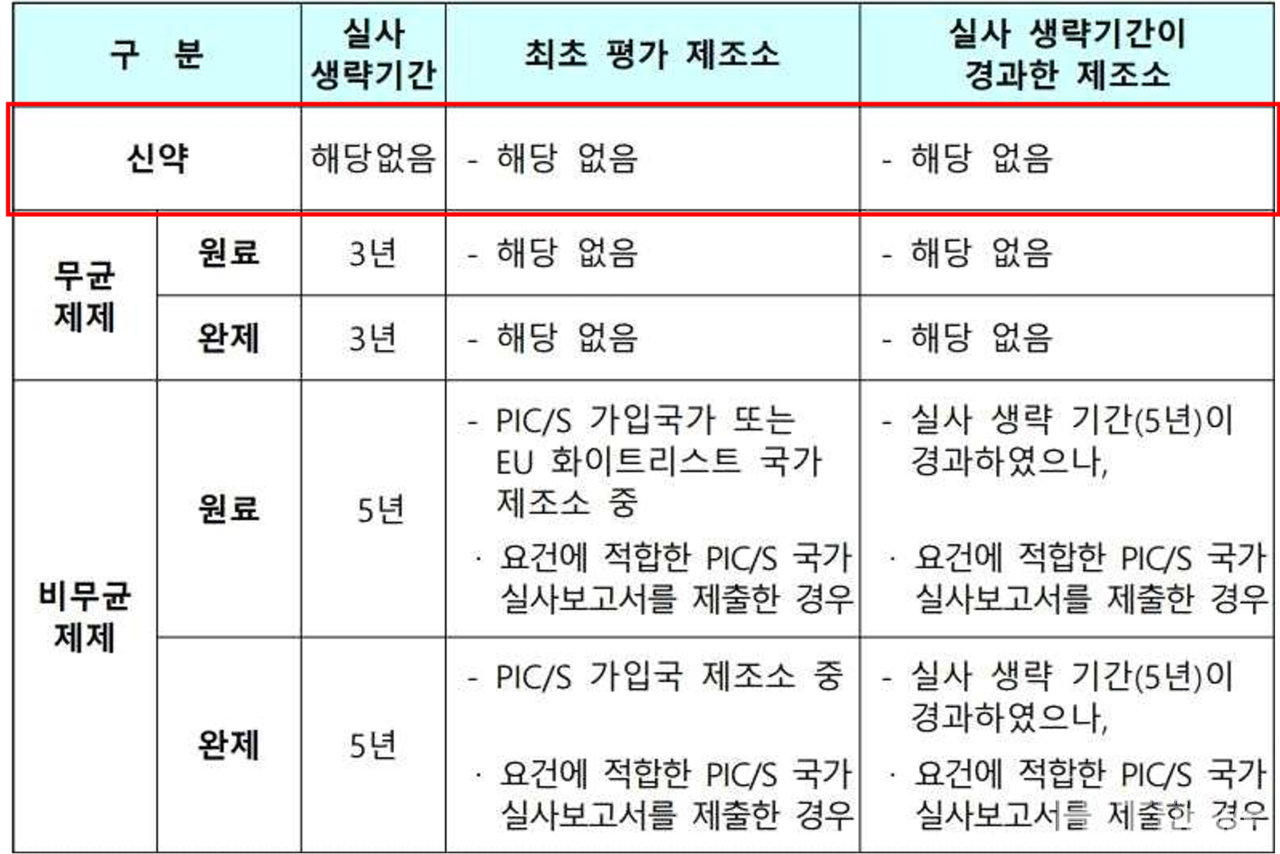
식약처는 이 외에도 사전 GMP 실태조사 생략대상에 신약 제조소를 추가했다.
기존에는 신약 여부와 상관 없이 무균제제(원료, 완제)는 3년, 비무균제제(원료, 완제)는 5년 등 실사 생략기간이 존재했다. 생략기간 동안에는 서류평가 만으로 사전 GMP 실태조사를 갈음할 수 있어 제약사들의 실사 부담이 덜어졌었다.
식약처 의약품품질과 관계자는 우선 GMP 평가 제도 시행 관련 "현재 식약처 인력 부족으로 사전 GMP 실사가 신속히 진행되지 못하고 있다"며 "그렇다보니 신속한 허가가 요구되는 의약품들의 실사 순서가 뒤로 밀려 처리 기한이 늦어지는 문제가 발생하고 있다"고 설명했다. 업계 애로사항을 받아들여, 필요한 품목을 우선적으로 사전 GMP 실사를 진행해 빠른 허가가 가능하도록 하려 한다고 덧붙였다.
이 관계자는 "실제로 실사 생략대상을 서류평가로 진행할 때, 현장 실사보다 요구 자료가 제대로 마련되지 않는 경우가 많았다"며 "그런 경우 실사 기간이 오히려 더 길어지는 경우가 있다"고 실태조사 생략대상에 신약 제조소를 추가한 배경을 설명했다.

