대웅제약, 3개 자회사 별 펙수프라잔 성분 허가
위캡정 10mg 앱시토정 10mg 벨록스캡정 10mg
BMS, 세 번째 면역항암제 '옵두알라그' EU 승인

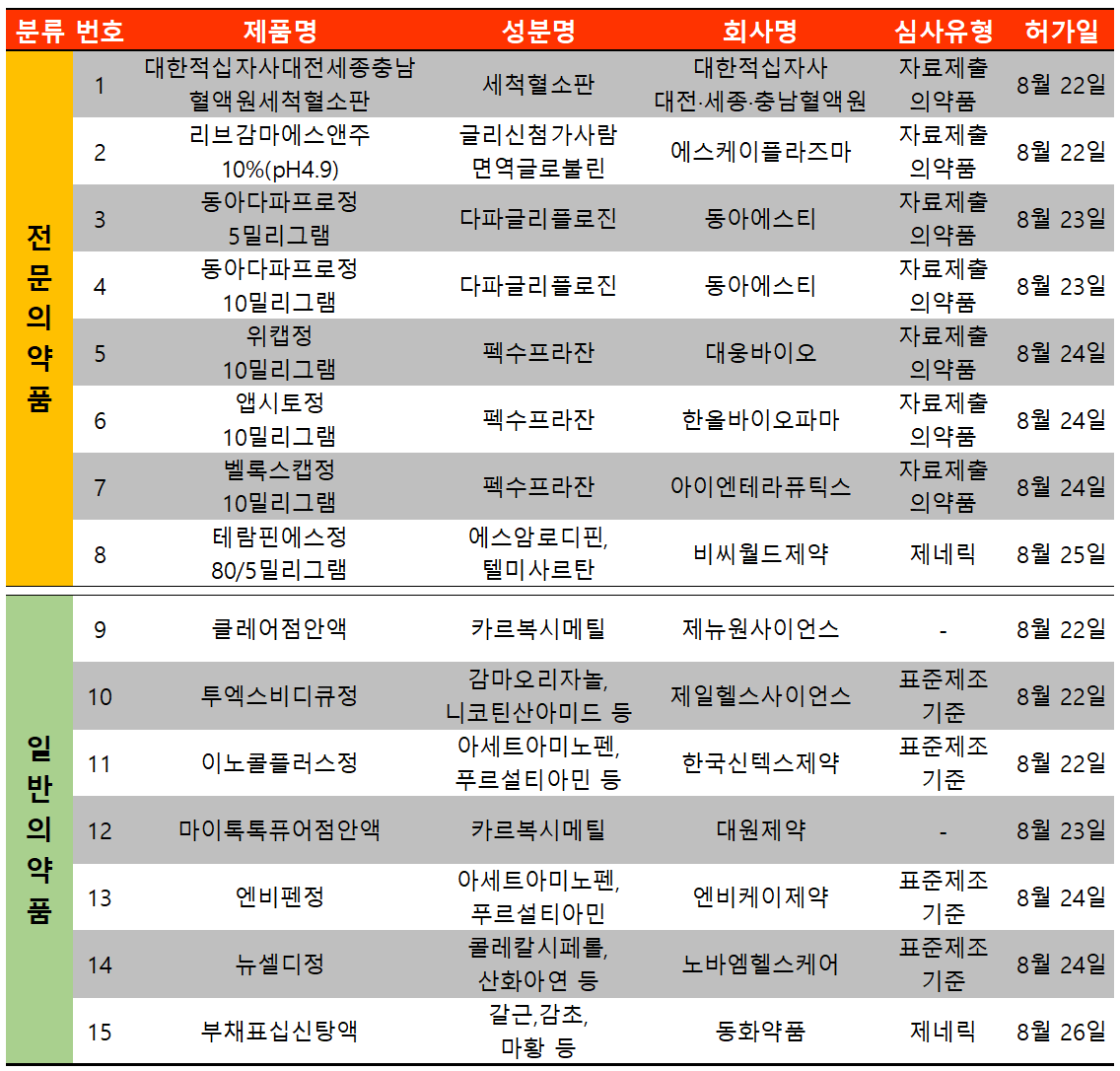
지난 주(8월 22일~8월 28일) 15개 품목이 식품의약품안전처에서 허가 받았다. 전문의약품은 8건, 일반의약품은 7건이었다.
대웅제약 자회사 또는 관계사는 위식도역류질환 치료제 펙수클루(성분 펙수프라잔) 저용량에 대한 품목을 허가받았다.
대웅제약은 △대웅바이오 △한올바이오파마 △아이엔 테라퓨틱스 등 3개의 자회사를 설립해 제약 산업뿐만 아니라 바이오 및 물질개발까지 영약을 확대하고 있다.
신약 펙수클루와 관련, 대웅제약은 자회사별로 △위캡정 10mg △앱시토정 10mg △벨록스캡정 10mg 등 같은 성분의 품목을 허가받도록 했다. 흔히 '쌍둥이약' 전략이라 불리는 위힘형 제네릭 방법으로 여러 품목들이 시장에 영향력을 미친다는 강점이 있다.
현재 HK이노엔의 전신인 CJ헬스케어는 오리지널 천식치료제 '싱귤레어(성분 몬테루카스트)'의 위임형 제네릭 '루케어'를 통해 연매출 100억 원대의 기록을 세운 바 있으며 대웅제약도 '알비스(성분 라니티딘)'의 위임형 제네릭 '가제트'를 허가받아 많은 이윤을 창출했다.
위식도역류질환 치료제 시장은 국내 시장규모 만으로 2021년 기준 7325억 원을 기록한 만큼 대웅제약은 이번 펙수클루 또한 쌍둥이약 전략으로 시장에 대한 주도권을 확보할 전망이다.
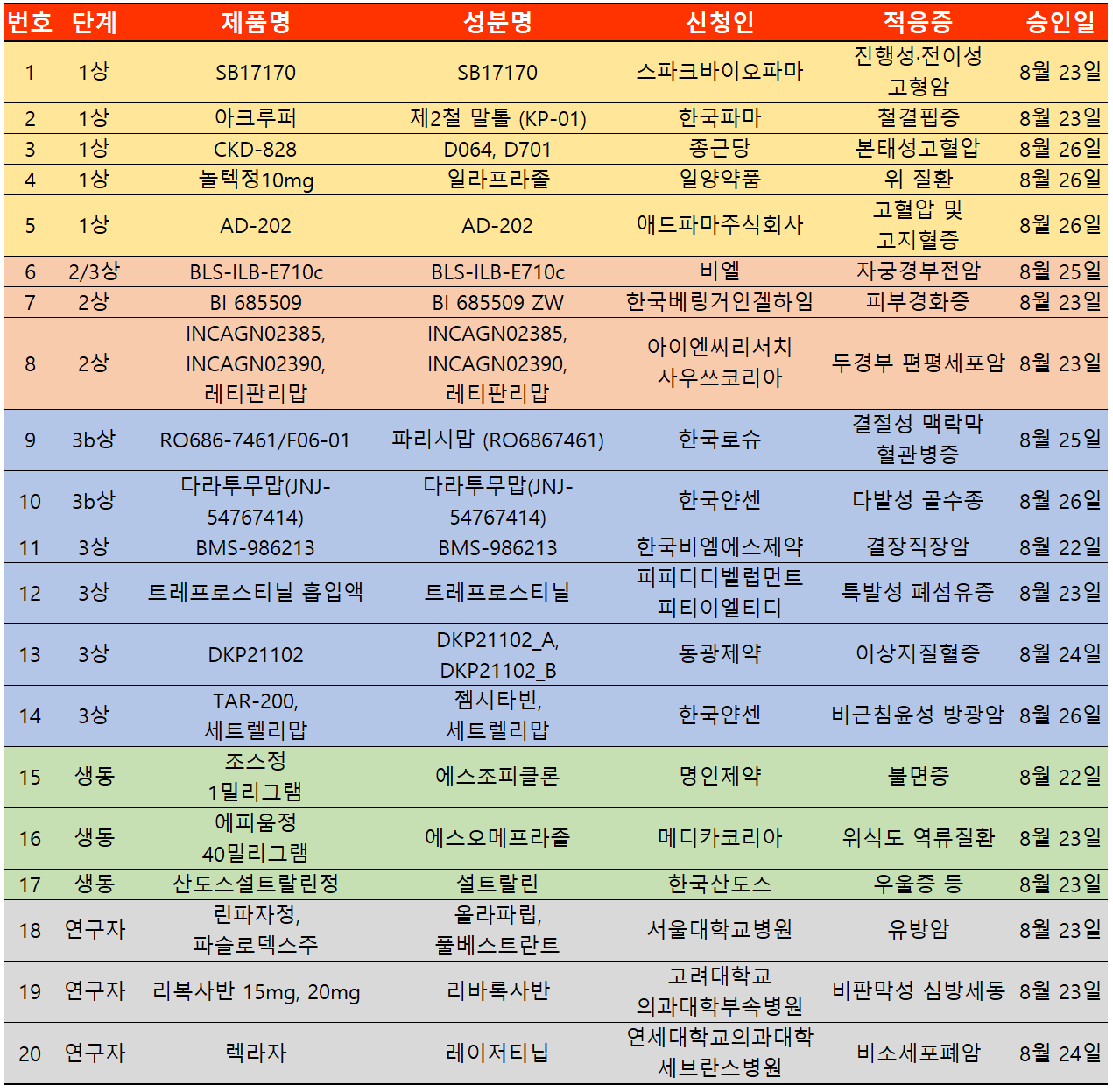
지난 주 임상시험계획은 총 20건이 승인됐다. 임상1상 5건, 2상 3건, 3상 6건, 생동 3건, 연구자 임상 3건 등이다.
BMS 면역항암제 옵디보(성분 니볼루맙)에 이어 개발된 옵두알라그(성분 렐라틀리맙)가 지난 7월 22일 유럽의약품청(EMA)에서 승인된 것에 이어 국내에서도 3상 임상시험 승인을 받았다.
옵두알라그는 종양세포 PD-L1 발현율 1% 미만인 12세 이상 청소년 및 성인의 진행성(절제 불가능 또는 전이성) 흑색종 1차 치료제로 옵디보와 고정 용량 복합제로 승인받았다.
하지만 국내에서 옵두알라그는 간세포암 2건과 결장직장암 1건에 대해 임상시험을 승인받았다. 이번 승인은 후속 차수 전이성 결장직장암 시험대상자에 대한 옵두알라그와 옵디보의 고정 용량 복합제 대비 레고라페닙 또는 트리플루리딘 + 티피라실(TAS-102)을 비교하는 제3상, 무작위배정, 공개(의뢰자 눈가림) 임상이다.
다국가로 진행되며 전체 환자수는 700명이고 국내 환자는 18명이 참여할 예정이다.
옵두알라그와 옵디보의 고정 용량 복합제는 옵디보가 PD-1을 억제하고 옵두알라그가 LAG-3 항체를 차단하는 기전으로 작용한다.
옵두알라그는 LAG-3을 억제하는 선두주자로 BMS가 선보인 세 번째 면역항암제인 만큼 해당 품목의 성공에 따라 새로운 면역항암제 요법이 등장할 것으로 예상된다.

