치매 시장 규모 2900억 원, 도네페질 그중 80%인 2300억 원
한독, 기존 DPP-4 억제제에 SGLT-2 억제제 합친 3제 임상승인

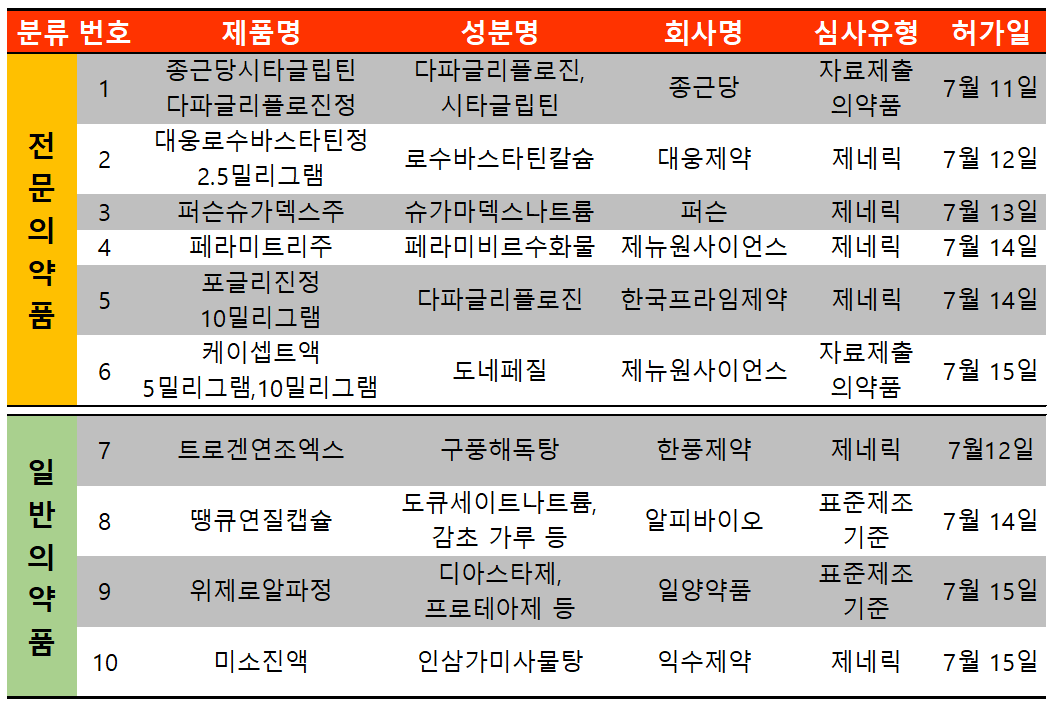
지난 주(7월 11일~7월 17일)에는 총 10개 품목이 식품의약품안전처로부터 허가받았다. 이 중 전문의약품은 6건, 일반의약품은 4건이었다.
전문의약품 중 제뉴원사이언스가 도네페질 제제 케이셉트를 정제가 아닌 액제로 알츠하이머형 치매증상 치료에 대한 적응증에서 케이셉트액 5, 10mg 두 용량을 허가받았다.
정제가 주류인 치매 치료제 시장에서 액제는 정제 섭취가 어려운 환자들이 선택할 수 있는 또다른 선택제가 될 수 있기 때문에 개발 초기부터 주목받아왔다.
유비스트 통계에 따르면 2020년 기준 국내 치매 치료제 시장 규모는 2900억 원가량으로 도네페질 성분은 이중 80%를 차지한 2300억 원 규모의 시장을 차지하고 있다.
제뉴원사이언스의 경우 케이셉트정 10mg을 2006년도, 케이셉트정 5mg을 2007년도에 허가받아 정제와 액제 두가지 선택지로 시장 경쟁을 이어갈 전망이다.
한편 도네페질 제제로는 오리지널제제인 에자이 아리셉트정, 삼진제약 뉴토인, 동아에스티 아리도네, 고려제약 뉴로셉트, 종근당 뉴로페질 등이 경쟁 중이다.
고령화에 따라 치매 시장은 매년 커질 것으로 분석되는 가운데 정제와 액제 외에도 패치형 등 다양한 신제형에 대한 연구가 이어지고 있어 추후 도네페질 제제의 경쟁은 더욱 치열해질 것이다.
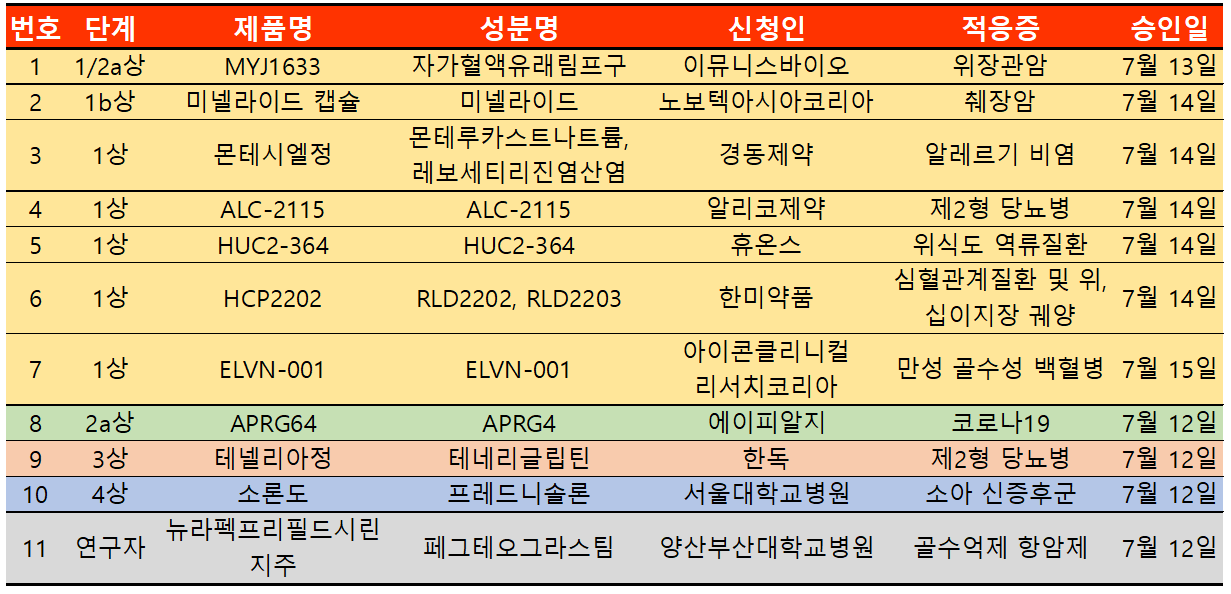
지난주 임상시험계획은 총 11건이 승인 완료됐다. 세부적으로 △임상1상 7건 △2a상 1건 △3상 1건 △4상 1건 △연구자임상 1건 등이다.
6월 이후부터 한독 메트포르민-테네리글립틴 복합제 '테넬리아'에 대한 후속 의약품 허가가 이어진 가운데 한둑은 메트포르민, 엠파글로플로진, 테네리글립틴을 병용하는 3제 요법으로 임상시험 3상을 승인받았다.
이번 임상시험은 메트포르민과 엠파글리플로진 25mg 병용요법으로 혈당 조절이 적절히 되지 않는 제2형 당뇨병 환자에게 테네리글립틴을 추가로 병용 투여하였을 때 유효성 및 안전성을 평가하기 위해 허가됐으며 전체시험대상자 208명 모두 국내에서 모집해 진행한다.
기존 테넬리아는 DPP-4 억제제 계열의 제2형 당뇨치료제로 이번 엠파글리플로진은 SGLT-2 억제제로 더 잘 알려진 성분이다.
GLT-2 억제제는 요당(Urinary Glucose) 분비를 증가시키는 약제이기 때문에 당 독성(Glucotoxicity)과 혈장량(plasma volume)을 감소시킨다. 그래서 SGLT-2 억제제는 췌장의 베타세포 활성화를 증가시키고 인슐린 저항성을 감소시킨다.
이와 반대로 DPP-4는 인크레틴 호르몬 효과를 통해 인슐린 분비를 증가시키게 되고 신장이나 혈관에 산화 스트레스(Oxidative stress)의 감소에도 도움이 된다.
그렇지만 DPP-4 억제제는 SGLT-2 억제제와 다르게 글루코스와 글루카곤의 분비를 감소시켜 두 약제가 서로 상호보완적으로 작용할 수 있는 가능성을 보이고 있다.
이 같은 병용요법의 장점으로 급여에 대한 논의도 이어지고 있기 때문에 이번 임상시험 종료 후 품목허가 또한 주목된다.

