2020년~2022년 7월까지 크론병 관련 7개사 국내 임상시험 진행
스카이리치 FDA 크론병 허가, 인터루킨-23 표적하는 억제제 중 최초

국내에서 건선 치료로 사용되는 한국애브비 스카이리치가 최근 FDA에서 크론병 치료로 적응증을 획득한 가운데 국내에서도 염증성 장 질환 중 하나인 크론병에 대한 다국적 제약사의 허가용 임상시험이 이어지고 있다.
식품의약품안전처에 따르면 2020년도부터 2022년 7월까지 승인받은 크론병 관련 국내 임상시험은 연구자 임상시험을 제외하고 총 7개사 14건으로 집계됐다.
환자 모집완료된 임상시험은 1건 △얀센 스텔라라, 모집중인 임상시험은 4건 △화이자 에트라시모드 △릴리 미리키주맙 △애브비 스카이리치 △다케다 킨텔레스, 승인완료된 임상시험은 6건 △아스트라제네카 브라지쿠맙 △애브비 ABBV-154 △얀센 트렘피어 △릴리 미리키주맙, 종료된 임상시험은 3건 △베링거인겔하임 BI 655130 이다.
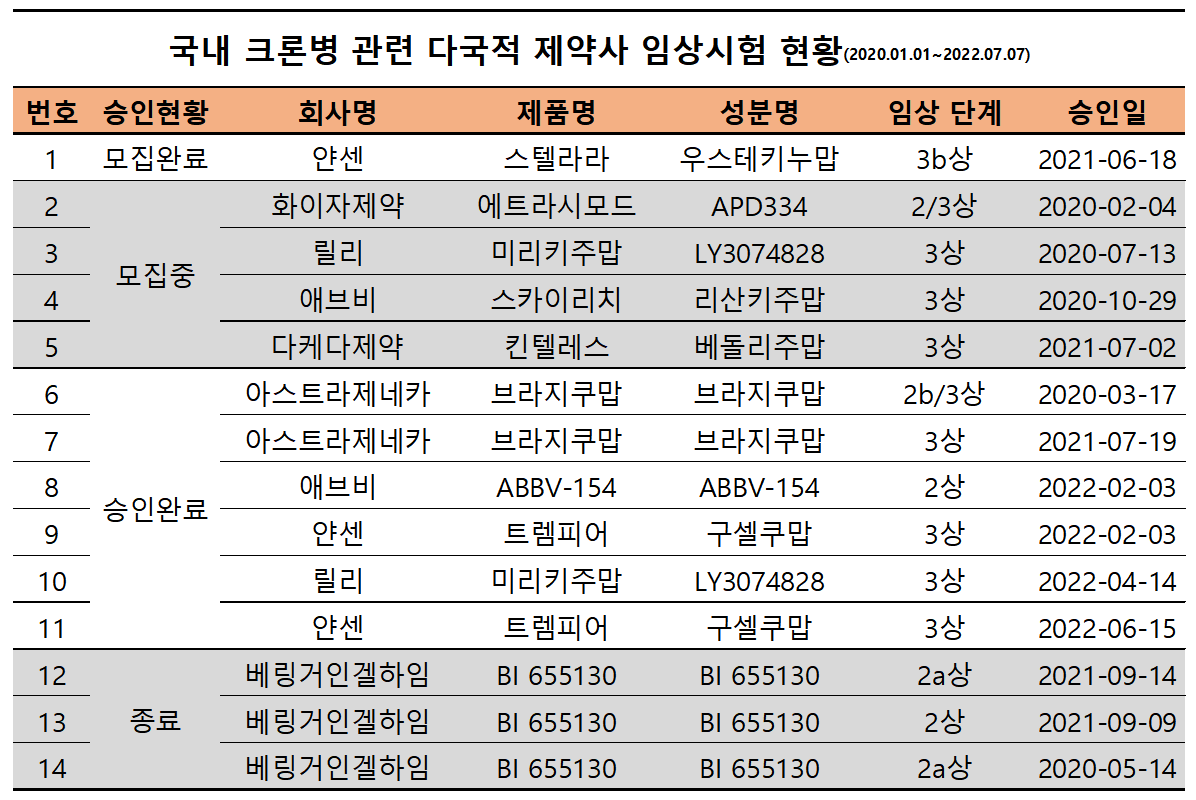
이중 현재 크론병 적응증을 가지고 있는 품목은 얀센의 스텔라라와 다케다의 킨텔레스뿐으로 나머지 약제는 적응증 추가 및 새로운 제품이다.
휴미라, 레미케이드 등 TNF-알파 억제제를 사용하던 치료 환경에서 염증 반응을 주요하게 관여해 증상을 억제하는 인터루킨 억제제의 등장으로 환자의 치료 옵션은 넓어졌다.
다만 스카이리치, 트렘피어 등은 염증성 장 질환 분야보다 건선 치료 시장에서 먼저 두각을 보였다.
기존 TNF-알파 억제제 휴미라, 레미케이드 또한 건선부터 염증성 잘 질환까지 넓은 범위의 적응증을 보유하고 있기 때문에 기전은 다르지만 같은 적응증에서 효과를 보이는 인터루킨 억제제 또한 영역을 넓히려는 시도를 진행하고 있는 것.
특히 스카이리치의 FDA 크론병 허가는 인터루킨-23(IL-23)을 표적하는 억제제 중 최초로 이뤄졌다. 스카이리치는 2건의 유도 임상 및 1건의 유지 임상 시험에서 내시경 반응의 유의한 개선을 입증했으며 유도 요법 및 유지 요법 모두에서 위약과 비교해 의미있는 결과를 보여줬다.
트렘피어 역시 글로벌 임상에서 크론병 관련 2상 GALAXI 1 임상 시험의 새로운 데이터를 발표한 바 있다. 임상 연구에 따르면 트렘피어는 기존 생물학적 제제 대비 내시경 반응 및 임상 관해 부분에서 임상적 효능을 보여줬다.
미리키주맙도 인터루킨-23 억제제로 효능과 안전성을 평가한 12주 임상 3상 유도 시험인 LUCENT-1에서 위약과 비교해 1차 평가변수인 12주 임상적 관해율 목표를 충족했으며 안전성 측면에서도 다른 임상연구 수준의 위험도를 보였다.
한국애브비 관계자는 "애브비는 염증성 장질환 환자들을 위한 치료제 공급을 위해 노력하고 있다"며 국내에서 스카이리치의 적응증 확대에 대해서는 아직은 확인이 어렵다고 답했다.
한국릴리 관계자는 "현재 미리키주맙의 국내 허가에 대해 내부 논의 중"이렴 "다만 아직까지 관련해서 확정된 사항은 없다"고 설명했다.
한편 대한장연구학회에 따르면 크론병의 의료비용 규모는 2016년 412억 원에서 2017년 674억 원, 2018년 786억 원으로 가파른 상승세를 보이고 있다.

