SGLT-2 억제제 복합제 제네릭 의약품... 오리지널 2021년 매출 285억
셀트리온, 휴미라 바이오시밀러 고용량... 신풍 코로나19 임상 재도전

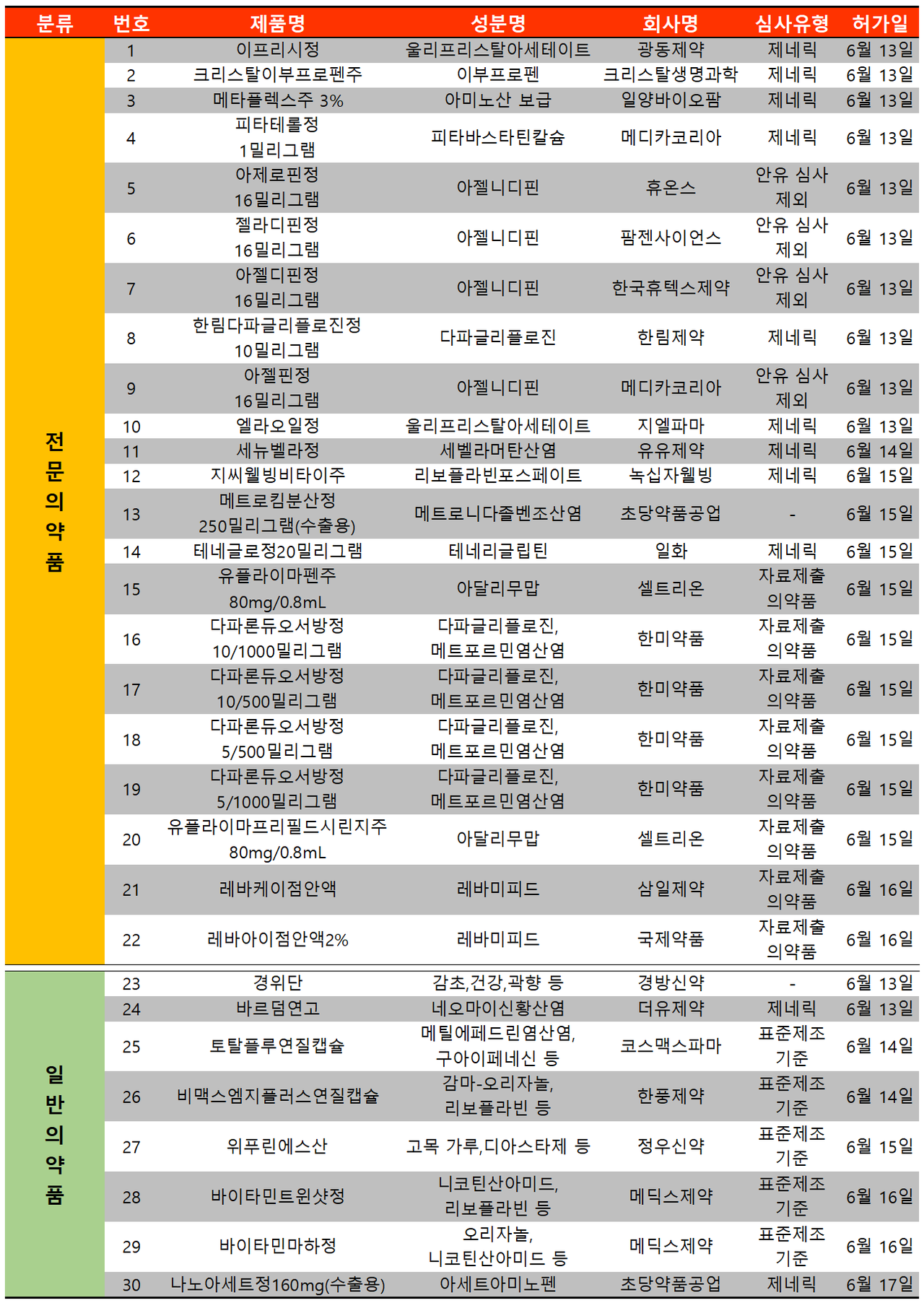
지난 주(6월 13일~6월 19일)에는 총 30개 품목이 식품의약품안전처로부터 품목허가를 받았다. 이 중 전문의약품은 22건, 일반의약품은 8건이었다.
만성질환 의약품이 다수 허가 받았다. 제2형 당뇨병 치료제가 총 6품목, 고혈압 치료제인 아젤니디핀이 4품목 총 10품목이 허가받았고 셀트리온이 아달리무맙의 바이오시밀러가 국내 상륙했다.
당뇨병 치료제 중 한미약품의 '다파론듀오' 5/500mg, 10/500mg, 5/1000mg, 10/1000mg 등 4개 용량에 대한 품목은 아스트라제네카의 SGLT-2 억제제 복합제 '직듀오'의 제네릭 의약품이다.
한미약품은 4품목에 대한 우판권을 확보해 2023년 4월 8일부터 2024년 1월 7일까지 9개월간 판매가 가능하다. 현재 직듀오의 제네릭 의약품은 25개사 53개 품목이 허가받았으며 우판권을 확보한 곳은 종근당, 보령, 경동제약, 일동제약, 제일제약 등 5곳이다.
유비스트 기준 2021년 직듀오 원외처방액 매출은 약 285억 원을 기록했다.
셀트리온은 2021년 10월 한국애브비 휴미라의 바이오시밀러 '유플라이마' 40mg 품목을 허가받았다. 이번 허가는 이에 2배 용량인 80mg 품목에 대한 허가가 진행된 것.
셀트리온은 2022년 2월 유럽에서 2배 용량 제품을 우선적으로 허가받아 전 세계적으로 오리지널과 경쟁하고 있었으며 국내까지 그 범위를 늘리고 있다.
현재 유플라이마의 적응증은 △류마티스 관절염 △성인 크론병 △건선 △궤양성 대장염 △베체트 장염 △화농성 한선염 △포도막염 △소아 크론병 등 8가지 항목이다.
한편 휴미라는 2021년 기준 약 207억 달러(한화 약 25조 3368억 원)의 매출을 기록했으며 삼성바이오에페스에서도 휴미라의 바이오시밀러인 '아달로체' 품목을 보유하고 있다.
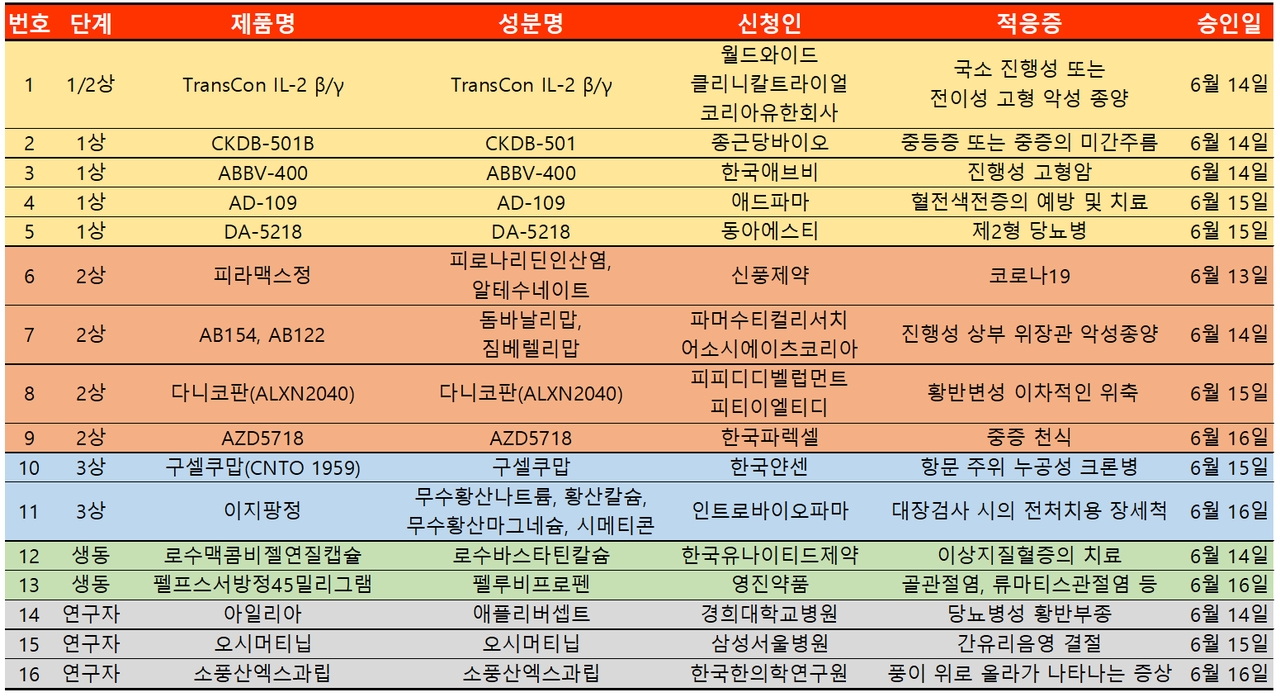
지난주 임상시험계획은 총 16건이 승인 완료됐다. 세부적으로 △임상1상 5건 △2상 4건 △3상 2건 △생물학적동등성 2건 △연구자임상 3건 등이다.
이번 임상시험은 항암제 분야부터 당뇨병, 천식, 미용, 크론병까지 다양한 적응증에서 승인이 이뤄졌으며 특히 코로나19 치료제에 대한 승인도 이뤄졌다.
코로나19 치료제 임상시험은 신풍제약 '피라맥스' 건으로 국내 임상시험 2상은 이번이 두 번째 시도다. 2상이 안전성과 유효성을 입증하는 단계인만큼 첫 번째 시험에서는 1차 평가변수를 충족하지 못했다.
그에 따라 첫 번째 시험에서 '임상시험용의약품 투여 후 7일 시점 코로나19 감염이 음성으로 판정된 자'였던 1차 평가변수를 이번 두 번째 시험에서는 '일차 유효성 평가변수임상시험용의약품 투약 후 코로나19 감염성 생존 바이러가 최초로 음전되기까지 걸리는 시간'으로 변경했다. 목표 시험자 대상 수 또한 110명에서 20명으로 대폭 감소했다.
피라맥스 투여군은 체중 기준으로 분류되며 65kg 이상에서 4정, 1일 1회로 총 3일간 투여 예정이고 45kg이상~65kg 미만에서는 3정, 1일 1회로 총 3일간 투여할 예정이다.
한편 신풍제약은 코로나19 치료제에 대한 피라맥스 3상 임상시험을 모집 중이다. 목표 시험자 대상 수는 1420명이고 1차 평가변수는 투약 후 29일까지 코로나19 입원 또는 사망자 비율이다.

