위해성 관리계획 제출 시기·임상시험약 안전성 정보 보고 등 개선

위해성 관리 계획의 제출 시기 개선, 에토미데이트 불법 구매자 과태료 부과, 임상시험용의약품 정기적 안전성 정보 보고 등 의약품 안전 사용환경 조성을 위한 총리령 '의약품 등의 안전에 관한 규칙' 개정안이 14일 입법예고 됐다.
현행 허가신청 시 위해성 관리 계획은 의무사항이지만, 앞으로는 제출이 어려운 경우 허가신청 시 개요만 우선 제출하고 허가 후 시판 전 1월 전까지 전체 계획을 제출할 수 있도록 개선된다.
아울러 위해성 관리 계획 이행으로 확인되는 안전성·유효성 평가 결과 등 최신 안전성 정보를 변경허가 신청·처리의 절차가 아닌 변경 명령으로 제품 허가사항에 신속 반영된다.
또한 구매자에게 과태료를 부과하는 불법유통 전문의약품에 전신마취 목적으로 사용되는 '에토미데이트' 성분 함유 의약품이 지정된다. 과태료 부과는 올해 7월부터 시행이 결정된 바 있다.
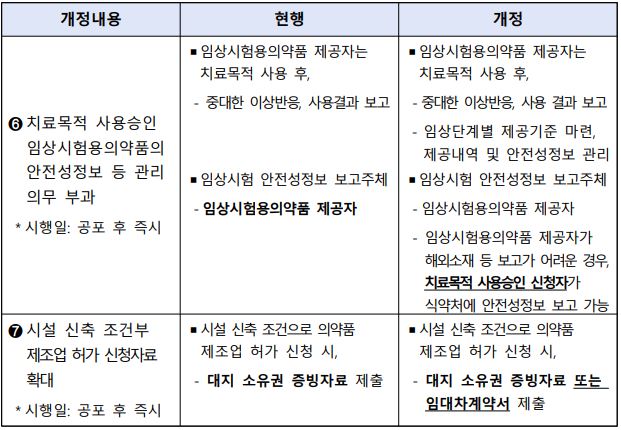
뿐만 아니라, 임상시험용 의약품에 대한 안전성 정보의 수시 보고 외에도 위해성 평가 등 종합적인 최신 안전성정보를 매년 정기적으로 보고해야 한다.
지난해 7월 20일 개정된 약사법으로 '거짓·부정한 방법을 통해 국가출하승인을 받은 경우'에 대한 행정처분 근거 또한 마련된다. 이에 행정처분 기준이 '허가취소'로 정해진다.
이 외에도 코로나19 백신과 같이 '공중보건 위기대응 의료제품'으로 지정된 생물학적제제 등의 신속한 공급을 위해 제품 출고 시 출하증명서를 발급하지 않을 수 있도록 한다. 출하증명서는 △제품명 △수량 △수령일시 △수령 시 온도 △인계인수자 확인 등을 기록한 문서다.
문은희 식약처 의약품안전국 의약품정책과장은 "이번 개정안이 환자의 안전한 의약품 사용환경을 조성하는 데 도움이 될 것으로 기대한다"며 "앞으로도 규제과학 전문성을 바탕으로 환자치료에 필요한 의약품의 안정적이고 신속한 공급을 위해 의약품 안전관리 제도를 적극 검토·정비하겠다"고 말했다.