"첨바법 취지와 제도 변화, 인체세포업 허가대상과 요건 등 다뤄"
식품의약품안전처(처장 김강립)는 23일 '첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률(이하 첨단재생바이오법)'에 대한 이해를 돕기 위해 민원인 안내서 '첨단재생바이오법 자주 묻는 질의응답집'을 발간·배포했다.
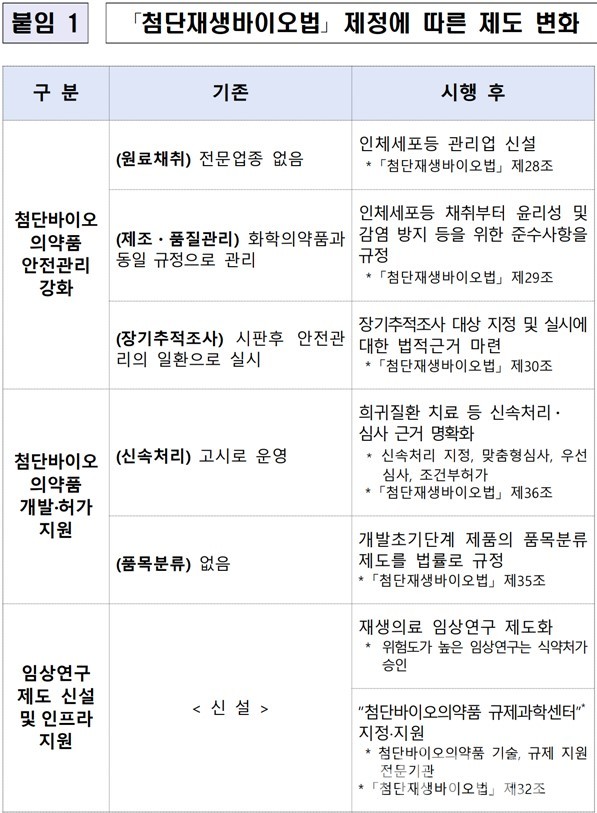
식약처에 따르면, 이 안내서의 주요 내용은 △'첨단재생바이오법' 취지와 제도 변화 △임상시험과 첨단재생의료 임상 연구의 차이 △'인체세포등 관리업' 허가대상과 허가요건 등이다.
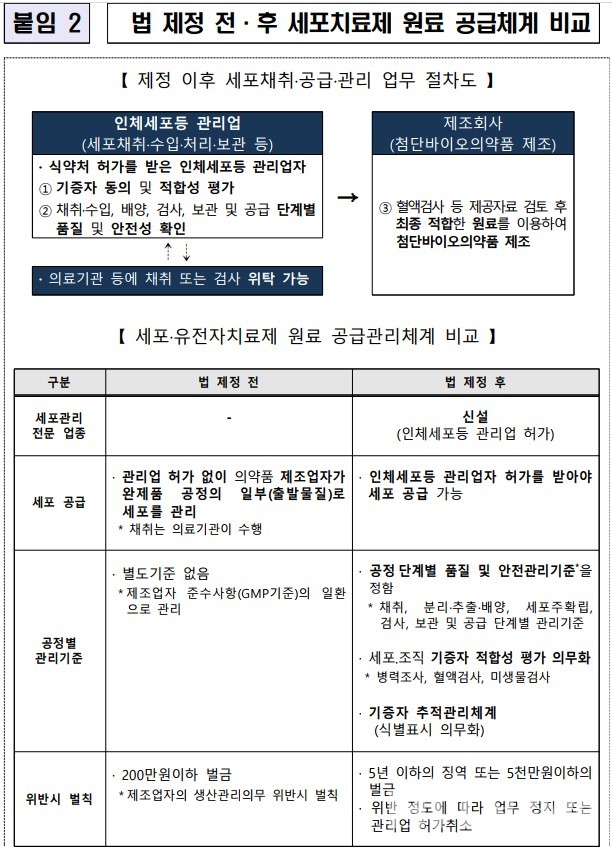
특히, 이번 안내서는 2020년 '첨단재생바이오법' 시행에 따라 신설된 '인체세포등 관리업'에 대한 상세한 설명을 질의응답 형식으로 추가했다.
식약처는 "이번에 발간된 안내서가 '첨단재생바이오법'과 '인체세포등 관리업'에 대한 관련업계의 이해를 높이는 데 도움을 줄 것으로 기대한다"며 "앞으로도 과학적 지식을 기반으로 규제과학 전문성을 강화해 첨단바이오의약품의 안전관리에 최선을 다하겠다"고 밝혔다.
한편, 자세한 내용은 '식약처 누리집(www.mfds.go.kr)→법령/자료→법령정보→공무원지침서/민원안내서'에서 확인할 수 있다.
황재선 기자
jshwang@hitnews.co.kr
바이오헬스케어 산업의 본질을 탐구하여 독자의 눈높이에 맞춰 전달하겠습니다.

