Kim's Weekly 1월 3주차 의약품 품목허가·임상승인 현황
코19 유전자재조합백신, 뉴백소비드프리필드시린지 허가
임상시험 3상 진입하는 암 치료제

식품의약품안전처가 SK바이오사이언스의 코로나19 백신 '뉴백소비드프리필드시린지'에 대한 제조판매 품목허가를 획득했다.
뉴백소비스프리필드시린지는 노바백스사가 개발한 백신으로 SK바이오사이언스가 원액부터 완제품까지 제조하는 유전자재조합 코로나19 백신이다.
지난주(2022.01.10~2021.01.16) 식품의약품안전처는 의약품 48품목(전문약: 36개, 일반약: 12개)과 임상시험 29건(1상: 15개, 2상: 3개, 3상: 7개, 연구자: 4개)을 각각 승인했다.
유전자재조합백신, 뉴백소비드프리필드시린지 허가
SK바이오사이언스가 제조하는 뉴백소비드프리필드시린지는 유전자재조합 백신이다.
유전자재조합 백신은 유전자재조합 기술을 이용해 만든 항원 단백질을 직접 주입해 면역반응 유도하는 방식으로 B형간염 백신이나 인유두종바이러스 백신(HPV(자궁경부암 백신)) 등이 재조합 백신 등 오랜기간 사용된 백신 플랫폼이다.
식약처 품목허가에 따르면 해당 백신은 0.5mL씩 3주 간격으로 2회 투여하며 다른 코로나19 백신과 호환성에 대한 자료가 없어 해당 품목으로 1차 투여를 받은 사람은 2차까지 뉴백소비드프리필드시린지로 2차 투여를 받아야 한다.
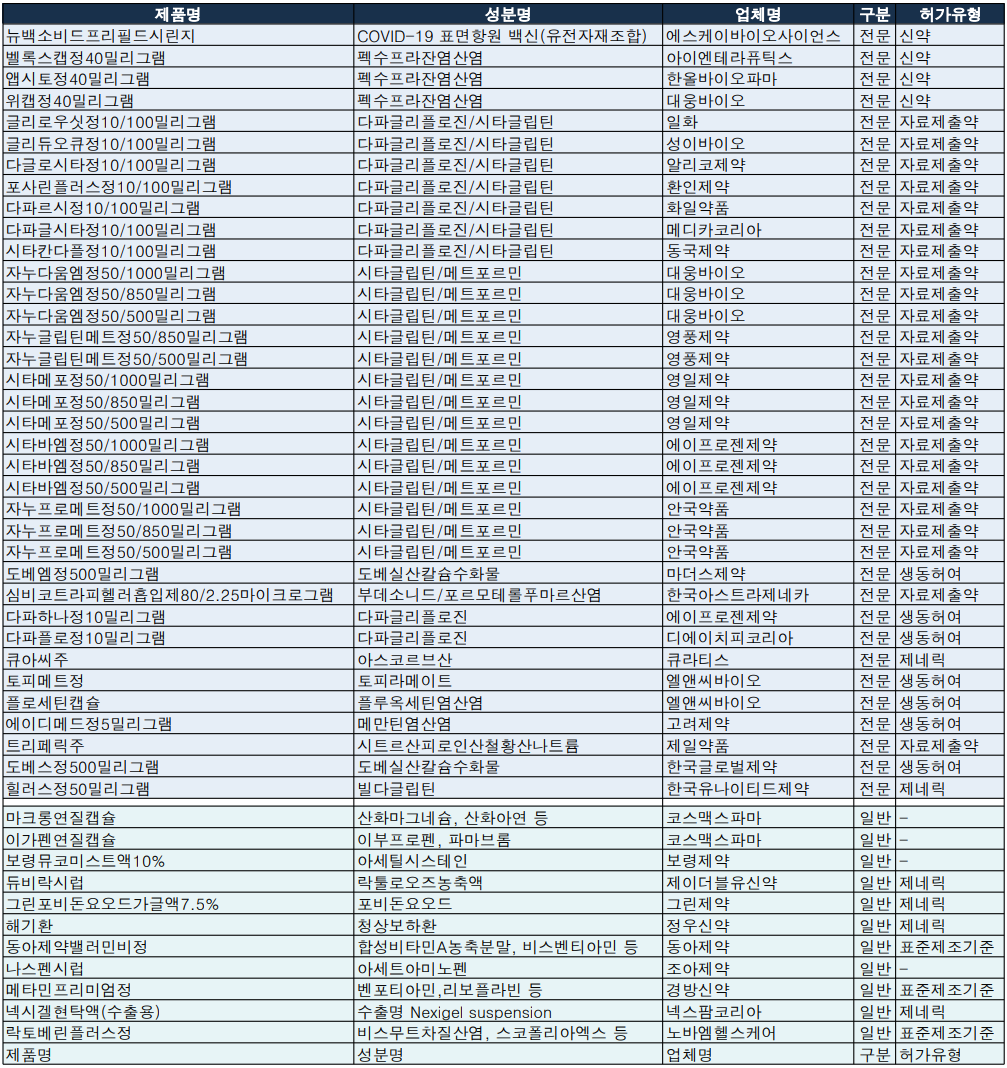
아울러 지난주 품목허가에서는 제2형 당뇨병 복합제가 대거 확인되기도 했다. 한국아스트라제네카 '포시가(다파글리플로진)'와 한국MSD의 '자누비아(시타글립틴)' 복합제와 한국MSD의 '자누메트(시타글립틴/메트포르민)' 제네릭이 쏟아졌다.
일화, 알리코제약, 환인제약, 화일약품, 메디카코리아, 동국제약은 다파글리플로진/시타글립틴 복합제인 '글리로우시정', '글리듀오큐정', '다글로시타정', '포사린플러스정', '다파르시정', '다파글시타정', '시타칸타플정' 품목허가를 획득했다.
대웅바이오, 영풍제약, 영일제약, 에이프로젠제약, 안국약품은 시타글립틴/메트포르민 복합제인 '자누다움엠정', '자누글립틴메트정', '시타메포정', '시타바엠정', '자누프로메트정'을 각각 허가받았다. 용량은 영풍제약을 제외하고 50/1000, 50/850, 50/500mg으로 동일했다.
또한 대웅바이오, 한올바이오파마, 아이엔테라퓨틱스는 펙수프라잔염산염 성분의 P-CAP계열 위식도역류질환 치료제 '벨록스캡정', '앱시토정', '위캡정'의 신약 품목허가를 획득했다.
임상시험 3상 진입하는 암 치료제
지난주 임상시험 승인 현황에는 임상시험 3상에 진입한 암 치료제가 다수 확인됐다.
한국엠에스디는 확장기 소세포폐암, 전이성 비소세포폐암 1차 치료에 대한 MK-7684A 두 건의 임상시험 3상을 승인받았다.
확장기 소세포 폐암 환자 1차 치료 임상시험은 MK-7684A와 Etoposide 및 백금제제의 병합요법, MK-7684A를 투여하는 요법을 Atezolizumab과 Etoposide 및 백금제제의 병합요법에 이어 Atezolizumab을 투여하는 요법과 비교하는 임상시험을 진행할 예정이다(국내 18명).
전이성 비소세포 폐암 환자에 대한 1차 치료로서의 MK-7684A + 화학요법을 Pembrolizumab + 화학요법과 비교하는 임상시험을 진행하며, 국내환자 28명(글로벌 700명)을 대상으로 고려대학교 구로병원, 충남대병원, 칠곡경북대병원, 화순전남대병원 등이 실시기관이다.
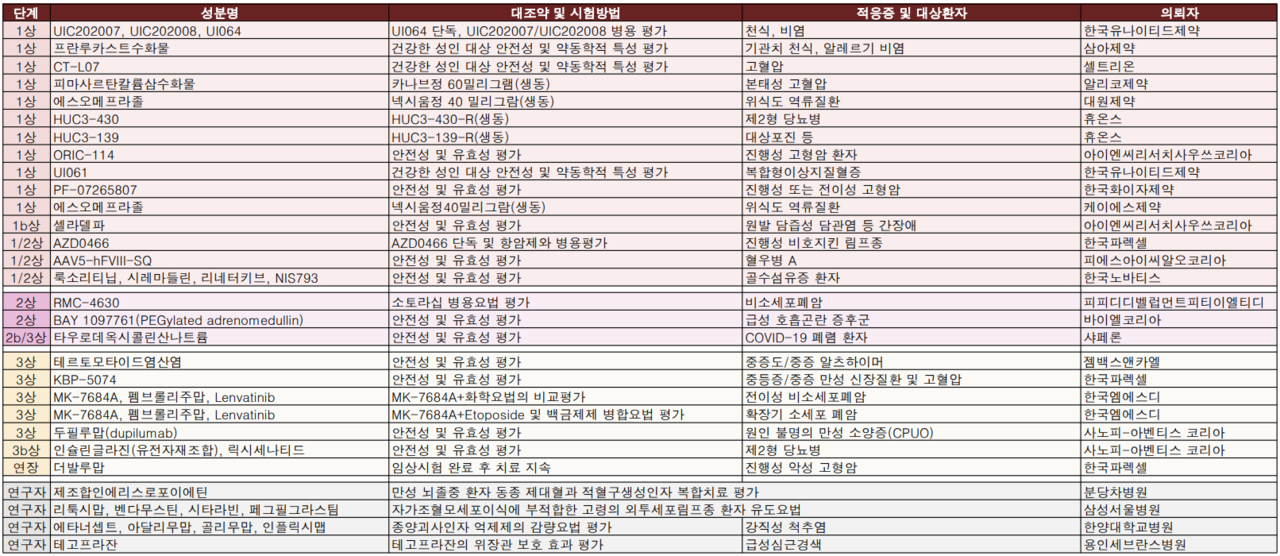
한국파렉셀은 더발루맙 선행 종양학 임상시험을 완료 환자 중 치료를 지속함으로써 임상적 이익을 나타낼 수 있을 환자에 대한 연장임상시험을 승인받았다. 국내 시험대상자수는 4명(글로벌 61명)으로 부산대병원, 삼성서울병원이 실시한다.
이밖에 샤페론은 COVID-19 폐렴 환자 1134명(국내)을 대상으로 NuSepin® 정맥주입의 유효성 및 안전성을 평가하는 임상시험 2b/3상을 실시할 예정이다.

