mRNA와 다른 RNA 기반 치료제_siRNA의 역사와 치료제 개발 동향

COVID-19 백신으로 RNA에 대한 관심이 높아졌다. RNA를 키보드 한글 자판으로 치면 ‘꿈’이 된다는 우스갯소리가 있다. 그래서 한국에서는 RNA 신약을 꿈의 신약으로 부른다는 이야기가 있다. COVID-19 백신에 사용된 RNA는 단백질을 번역할 때 사용하는 mRNA (메신저 RNA)로 세포 속에 들어가서 스파이크 단백질을 만들고, 더 나아가 그 것에 대한 항체를 생성하는 초기 물질로 작용한다. mRNA 기술은COVID-19 백신을 통해 실용화 및 상업화에 성공 했고, 다른 백신과 치료제로 응용하려는 시도가 폭발적으로 증가하고 있다. 또 다른 RNA인siRNA(small interference RNA, 짧은 간섭 RNA)는 2018년부터 이미 미국 식품의약국(FDA) 승인을 받아 치료제로 사용 중이다.
RNA에 의한 간섭현상은 1990년대 초반 발견되었으나, 1998년 Carnegie Institution of Washington, Mayrland 앤드류 파이어 박사와 크레이그 멜로 박사가 예쁜꼬마선충(C. elegance)에서 unc-22 단백질을 녹다운(knockdown)하는데 단일 가닥(single-stranded)이 아닌 이중 가닥(double-stranded) RNA가 필요함을 보고하였다.(1) 2001년 Max-Planck-Institute의 Tuschl박사 팀은 21개의 핵산으로 이중가닥 RNA를 합성하여 포유 동물 세포에 넣어줬을 때 타겟 유전자의 단백질 발현이 낮아지는 것을 보고하였다.(2) 이 후로 siRNA의 작용 기전에 대한 기초 연구와 치료제로서 응용해 보려는 노력이 활발해졌다. 더 나아가, 초기 보고자인 파이어 박사와 멜로 박사는 그들의 공로를 인정받아 2006년 노벨 생리학상을 받았다.(3) 논문 발표한지 10년도 안된 상태에서 노벨상을 받았는데, 그 당시siRNA에 대한 관심이 얼마나 컸는지 가늠할 수 있다.
siRNA의 작동 기전
siRNA는 22개의 뉴클레오타이드로 합성을 통해 이중 가닥으로 만들어서, 세포 안에 전달해 주면 RISC(RNA-induced silencing complex)와 결합한다. RISC는 이중 가닥 중 target mRNA의 상보적 가닥을 남기고, mRNA를 스캔하면서 서열의 상보성 여부를 확인한다. 상보성이 존재하면, target mRNA를 자르게 되고, 그 양을 줄이게 된다. 더 나아가 단백질의 번역도 줄여서 결국 target단백질의 양도 줄게 된다. (그림1)
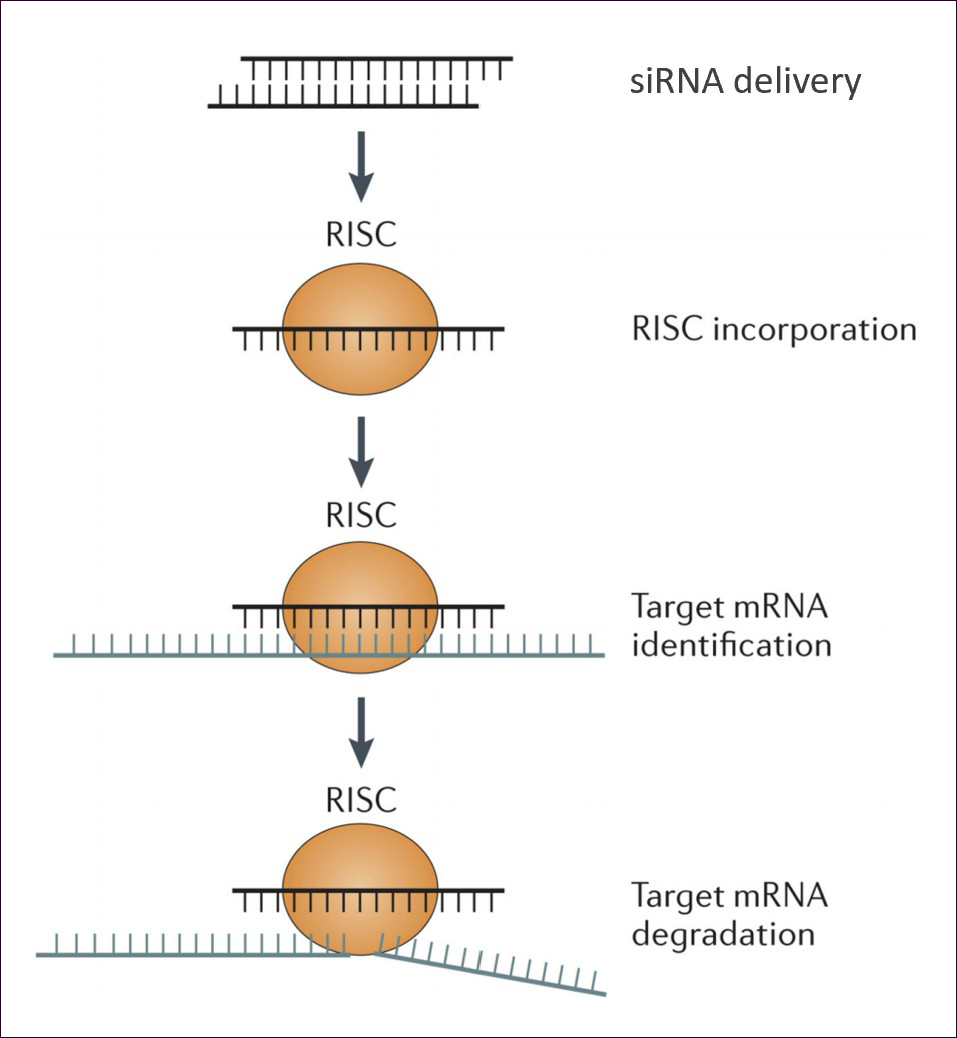
siRNA 치료제 개발의 어려움
Target mRNA가 질병에 관여한다면, siRNA를 이용해서 그 단백질 발현을 knockdown시킬 수 있고, 질병을 개선할 수 있게 된다. 따라서, siRNA를 치료제로 개발하려는 노력이 계속 진행 중이다. 다른 신약 개발과 마찬가지로, siRNA는 siRNA대로의 극복해야할 두 가지 큰 어려움이 있다. 생체 내로 들어간 siRNA의 안정성(stability) 확보와 siRNA를 생체 내 표적 세포까지 전달하는 것이다.
는 몸에 들어가게 되면 nuclease (RNA를 자르는 효소)에 의해 분해 되고, 또한 일차 면역 반응을 일으켜 원치 않는 부작용이 일어날 수 있다. 많은 연구를 통해 뉴클레오타이드를 구성하는 염기, 당, 그리고 인산에 화학적 수정 (예를 들면, 2´-O-methyl and 2´-fluoro modification)을 가하면 이러한 어려움을 극복할 수 있음이 증명되었다. (5)
두번째 장벽은 생체 내 표적 세포까지 전달하는 것인데, siRNA를 그냥 생체에 넣어주면 거의 대부분이 원하는 표적 장기에 가지 않고, 신장을 통해서 배출 된다. 이 것을 극복하기 위해서 PEG (Polyehyl glycol)을 결합해서 분자량을 높여 배출을 늦춰보려는 시도도 있었으나, 실패했다. 다른 방법으로는 현재 mRNA 기술에 사용하는 것과 같은 지질 나노 입자(LNP: Lipid Nano Particle)를 사용해서 안정성을 높이고, 입자 표면에 수용체를 접합하여 특정 장기로 전달하는 것이 가능해졌다. 또한 최근에는 이중 가닥 siRNA의 한쪽에 수용체에 특이적으로 결합하는 리간드를 직접 붙여서 생체에 직접 전달하는 방법도 개발되었고, 실제로 약으로 승인을 받았다. (5)
FDA에서 승인 받은 siRNA 치료제
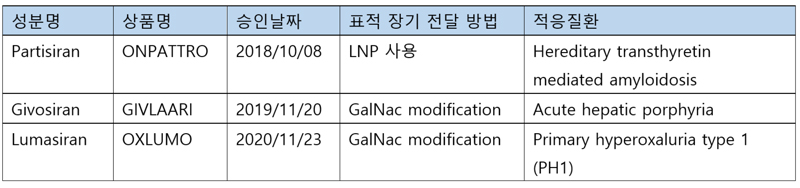
지금까지 FDA로부터 약으로 승인받은 siRNA치료제는 3가지가 있다. (테이블 1)
세가지 약 모두 미국 메사스세츠주 캠브리지에 위치한 Alnylam에서 개발하여 승인을 받았다. 또한, 이 약들 모두 siRNA에 화학적 수정을 통해 안정성을 높였고, 간으로 특이적으로 전달되도록 하여 간질환에 적용된다. Alnylam은 2002년에 설립한 회사로, siRNA의 포유동물세포에서의 사용 가능성을 보고한Tuschl 교수(2)가 설립자로 참여하였다. 2004년 미국 나스닥 주식 상장을 통해 자금 조달을 하였으며, 2021년 현재 23.2조의 시총을 가진 회사로 성장하였다.
Partisiran은 다양한 조성의 물질들(예를 들어, cholesterol, polar lipid DSPC, PEG2000-C-DMG, DLin-MC3-DMA 등)이 포함된 LNP를 사용하여 간세포의 ApoE receptor에 결합한다. 그리고, 엔도사이토시스 (Endocytosis)를 통해 세포내로 전달되어 TTR (transthyretin) mRNA를 줄이게 된다. TTR 유전자에 돌연변이가 생기면 장기 내에 아밀로이드 침착이 증가하여 신경성 질환, 심근질환 등을 일으킨다. 이 약은 환자에게 정맥주사로 투여해야 한다. (6)
Givosiran과 Lumasiran은 LNP가 아닌 N-acetylgalactosamine (GalNac) sugar 3개를 이중 가닥 siRNA의 3’ 끝에 접합시켜 간세포 표면에 많이 발현하는 asialoglycoprotein (ASGPR) 수용체에 특이적으로 결합하도록 디자인했다. LNP에 비해 장점은 정맥 주사가 아닌 피하주사를 통해 한 달에 한 번 투여할 수 있다는 점이다. Givosiran은 ALAS1(aminolevulinate synthase 1) mRNA를, Lumasiran은 glyoxylate oxidase (GO) mRNA를 표적으로 한다. (6)
이러한 약들의 승인을 통해, siRNA 치료제에 대한 관심이 다시 증가하고 있으며, 현재 7개의 후보 siRNA가 임상 3상 실험 중에 있다. (테이블 2)
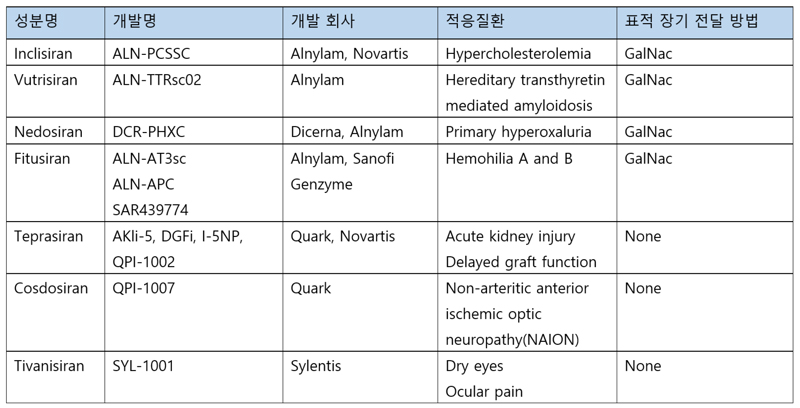
간질환 siRNA치료제를 넘어
siRNA 개발의 어려움으로 여겨졌던 안정성 문제는 FDA로부터 siRNA가 약으로 승인을 받기 시작하면서 어느 정도 극복 되었으나, 두번째 문제인 표적 장기에 특이적으로 전달하는 점은, 승인 받은 약들과 임상 3상에 있는 많은 약들이 GalNac을 이용한 간세포로의 전달에 집중되어 있다는 면에서 여전히 극복해야 할 과제이다. 간세포 이외의 세포에 특이적으로 전달하려고 주로 시도되는 방법은 GalNac과 같은 바이오 물질을 화학적이든 링커를 사용해서든 siRNA에 접합시키는 것이다.
최근 Alnylam은 Peptidream이라는 일본 바이오테크 회사와 최대 2.2조 규모의 협력 연구 계약을 체결하였다.(7) Peptidream은 다양한 장기에 특이 전달 능력이 있는 펩타이드(작은 아미노산 결합체) 라이브러리를 가지고 있는데, Alnylam이 자신들의 siRNA 기술력을 간질환 이외의 장기 질환에 적용하고자 이러한 계약을 체결하였다. 또한, Avidity biosciences는 항체에 siRNA을 접합하여 특정 장기로 보내려는 연구 개발을 활발히 진행하고 있다.(8) 세포막 성분인 지질 (Lipid)이나 콜레스테롤을 siRNA에 접합하여 세포막 통과를 용이하게 하여 다양한 장기의 세포에 전달하려는 노력도 계속 진행 중이다.
백신을 통해 RNA에 많은 관심이 생겼고, 이 것이 분명 다른 RNA 치료제인 siRNA로 확장될 것이다. 현재까지 나와 있는 간질환을 대상으로 하는 siRNA 치료제 뿐 아니라, 곧 다른 장기 질환, 나아가 암을 치료할 수 있는 siRNA 치료제가 나오길 고대한다.
1. Fire, A., Xu, S., Montgomery, M. K., Kostas, S. A., Driver, S. E., and Mello, C. C. (1998) Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature 391, 806– 811
2. Elbashir, S. M., Harborth, J., Lendeckel, W., Yalcin, A., Weber, K., and Tuschl, T. (2001) Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells. Nature 411, 494– 498
3. https://www.nobelprize.org/prizes/medicine/2006/7474-the-nobel-prize-in-physiology-or-medicine-2006-2006-4/
4. Wittrup, A. and Lieberman, J. (2015) Knocking down disease: a progress report on siRNA therapeutics. Nat Rev Genet. 16, 543–552
5. Hu, B., Zhong, L., Weng, Y., Peng, L., Huang, Y., Zhao, Y., Liang, X. (2020) Therapeutic siRNA: state of the art. Signal Transduction and Targeted Therapy 5, 101
6. Zhang, M., Bahal, R., Rasmussen, T., Manautou, J., Zhong, X. (2021) The growth of siRNA-based therapeutics: Updated clinical studies. Biochemical Pharmacology 189, 114432
7.https://www.businesswire.com/news/home/20210729006108/en/Alnylam-and-PeptiDream-Enter-into-Collaboration-Agreement-to-Discover-and-Develop-Peptide-siRNA-Conjugates-for-Targeted-Delivery-of-RNAi-Therapeutics-to-a-Broader-Range-of-Extrahepatic-Tissues
8. http://www.aviditybiosciences.com/platform/

