신상준 연세암병원 교수, 벨바라페닙-코비메티닙 1상 발표
포지오티닙, 비소세포폐암 뇌 전이 환자 유효성 발표 등
한미약품이 개발한 항암신약 후보 4종의 임상시험을 진행하고 있는 파트너사들이 최근 미국 임상종양학회(ASCO)에서 임상 연구결과를 공개했다.
한미약품은 지난 4일부터 온라인으로 개최된 '2021 ASCO'에서 자사의 항암신약 후보의 상용화를 개발 중인 파트너사들이 주요 임상 연구결과를 구연 및 포스터로 발표했다고 7일 밝혔다.
권세창 한미약품 사장은 "긴밀한 연구협력을 맺고있는 파트너사들이 세계 최대 규모의 암학회에서 개발중인 혁신신약의 유효한 결과를 발표하게 돼 기쁘다"며 "최근 네이처지에 벨바라페닙의 연구결과가 등재되는 등 글로벌 학계에서도 한미 개발 혁신신약을 주목하고 있다"고 말했다.

"벨바라페닙, NRAS 변이 흑색종 환자 최고반응률 고무적"
우선 제넨텍은 진행성 고형암 환자 대상으로 '벨바라페닙'과 '코비메티닙' 병용 연구 결과를 공개했다. 한미약품은 2015년 로슈 자회사 제넨텍에 벨바라페닙을 기술수출한 바 있다. 벨바라페닙은 강력한 선택적 RAF 이합체 억제제로, RAF와 RAS 변이로 인한 고형암에서 항종양 효과를 나타낸다.
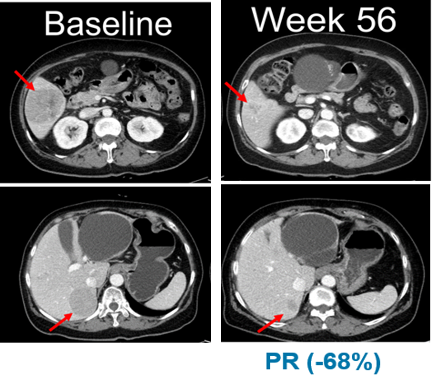
이번 임상1b상 연구는 BRAF, NRAS 단백질 변이 고형암 환자 대상으로 용량증량 및 적응증 확장을 시험했다. 적응증 확장 임상의 NRAS 변이 흑색종 연구에서는 13명의 환자 중 5명이 부분반응(PR)을 보였으며, 최고반응률(BORR)은 38.5%로 였다.
13명의 환자 중 11명은 이전에 면역관문억제제(CPI)를 투여 받았으며, 면역관문억제제 투여 환자군 대상 최고반응률(BORR)은 45.5%로 확인됐다. 무진행생존기간(PFS)의 중간값은 7.3개월이다.
발표를 진행한 신상준 신촌세브란스 연세암병원 종양내과 교수는 "이번 연구를 통해 벨바라페닙의 우수한 안전성 및 항암효과를 확인했다"며 "특히 NRAS 유전자 돌연변이를 지닌 흑색종 환자에서 고무적인 효과를 확인할 수 있었다"고 말했다.
포지오티닙, 뇌전이서 임상적 치료 유용성 확인
폐암신약 후보 '포지오티닙'을 개발 중인 스펙트럼은 EGFR(상피세포 성장인자 수용체) 또는 HER2 Exon20 돌연변이 비소세포폐암 (NSCLC) 환자에서 포지오티닙의 중추신경계(CNS) 활동 결과를 포스터로 발표했다.
총 284명 환자 중 뇌전이를 가진 36명 대상 연구 결과 3명(8%)에서 종양이 완전 소실되는 '완전관해(CR)을 보였다. 뇌 종양은 비소세포폐암 환자의 최고 25%에서 흔히 발생하는 전이로, 짧은 생존기간과 관련이 있다. 환자들은 포지오티닙 16mg을 1일 1회 투여받았다.
프랑수아 레벨 스펙트럼 최고의학책임자는 "이번 데이터는 EGFR 혹은 HER2 Exon 20 삽입 돌연변이를 가진 중추신경계(CNS) 전이 환자에서 포지오티닙의 의미있는 임상적 치료 유용성을 보여준다"고 설명했다.
오라스커버리 플랫폼 적용한 오라독셀 데이터 최초 발표
아테넥스는 한미약품의 '오라스커버리(ORASCOVERY)' 플랫폼을 적용해 '도세탁셀' 항암제를 경구용으로 전환환 '오라독셀(도세탁셀+엔서퀴다)'의 임상 1상을 발표했다.
이어 정맥주사용 항암제 파클리탁셀을 경구용으로 전환한 오락솔의 분자아형(Molecular subtype)에 따른 항암효과를 분석한 임상 3상 추가 하위분석 데이터 2건을 각각 포스터로 발표했다.
오라독셀 투여 시 용량 제한 독성 또는 약물 관련 심각한 부작용은 없었다. 또한, 평균 절대적 생체 이용률은 15.9% 였으며, 300 mg/m2 용량에서 약동학(PK)이 비선형(non-linear)으로 나타났다. 이 임상을 바탕으로 아테넥스는 오라독셀 300 mg/m2 용량 분할에 대해 추가적으로 평가하고 있다.

