"미국 임상 1상은 올해 4월 중 진행할 예정"

큐라클이 "당뇨병성 신증 신약 개발을 위해 진행한 임상시험 2상에서 유의미한 결과를 얻었다"고 발표했다.
큐라클(대표이사 김명화, 박광락)은 당뇨병성 신증 치료제 CU01-1001 임상 2a상 Topline 결과, 유효성과 안전성을 확인했다고 26일 밝혔다.
이번 임상시험은 영남대학교병원을 포함해 5개 병원에서 실시했다. 알부민뇨가 나타나는 제2형 당뇨병성 신증 환자 42명을 모집해 기존의 당뇨병 치료제(ACE 억제제 또는 ARB)를 유지했다. 시험약 CU01-1001 또는 위약을 12주 동안 하루 2회 경구 투약하여 약동학적 분석 및 유효성, 안전성 평가를 진행했다.
통계 분석 결과를 살펴보면, CU01-1001 투여군에서 사구체 여과율(eGFR)의 유의한 증가가 관찰됐다.(60.60mL/min/1.73㎡에서 64.40 mL/min/1.73㎡, 변화량 3.80 mL/min/1.73㎡). 가장 빈번히 발생한 이상반응으로는 홍조(안면홍조 포함), 오심이 각각 18.18%, 13.64%의 비율로 나타났고, 중대한 약물이상반응은 1건도 관찰되지 않아 CU01-1001의 안전성과 내약성을 확인했다.
임상시험 총괄책임자인 영남대학교병원 내분비대사내과 원규장 교수는 "국내 제2형 당뇨병성 신증 환자의 사구체 여과율이 매년 평균 2.42mL/min/1.73㎡씩 떨어짐에도 불구하고 본 약제를 12주 투여 후에 3.80mL/min/1.73㎡ 증가가 관찰됐기 때문에 향후 본 약제가 제2형 당뇨병성 신증 환자들을 위한 새로운 치료 옵션이 될 것으로 기대된다"고 전했다.
김명화 큐라클 대표는 "최근 각광을 받고 있는 SGLT-2 억제제가 긍정적인 심혈관 및 신기능 임상시험 결과를 보여줬다"며 "10년 이상의 만성 대상 질환자인 경우, 신장 섬유화에 의한 신장기능이 매우 약화돼 있으며 만성적인 신장기능 저하는 신장 섬유화와 깊게 관련돼 있다"고 밝혔다.
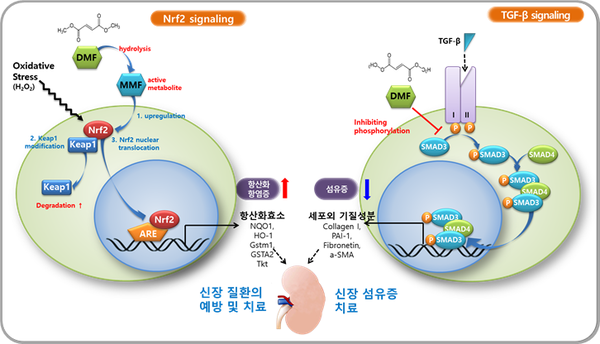
또 "현재 시장에 나와 있는 경구용 신섬유화 억제제는 없는 실정이다. CU01-1001은 직접적인 신섬유화 억제 효능을 동물실험에서 검증했기 때문에 SGLT-2 억제제와는 분명한 차별성을 갖는 약물이다"이라며 "CU01-1001는 Nrf2를 활성화하면서 동시에 TGF-β/Smad를 억제하기 때문에 신장 섬유화까지 치료할 수 있는 새로운 작용기전의 혁신 신약"이라고 말했다.
강지혜 큐라클 임상개발본부장은 "이번 2a 임상 결과에서 CU01-1001은 임상적으로 유의한 사구체여과율의 뚜렷한 개선과 단백뇨 증상 개선 효과를 보였다"며 "이번 결과는 국제학회와 저널에 발표할 계획이며, 추가적인 안전성 확인과 신장기능 회복 효과 입증을 위한 후기 임상시험도 2a 시험을 수행한 CRO 디티앤사노메딕스와 준비하고 있다"고 전했다.
한편, 큐라클은 지난달 26일 미국 식품의약국(FDA)로부터 경구용 당뇨황반부종 신약 CU06-1004의 IND승인을 받아 4월부터 미국 임상 1상 시험을 시작할 계획이라고 밝혔다.

