PMS 변경·임상 재평가·생동성실시·세포치료제 조건부허가 등 타당성 자문…
해마다 회의 개최실적·안건 심의 증가
식품의약품안전처 중앙약사심의위원회가 2018년 한 해동안 총 62번의 회의를 열고 약사법 제18조에 근거한 정부의 자문업무를 수행한 것으로 조사됐다.
제제별 PMS 계획 변경, 임상재평가를 진행한 SK케미칼 '바리다제정'의 임상시험계획서의 타당성, 임상재평가 결과에 따른 방향설정 및 조치사항, 국외 의약품 안전성 정보에 따른 안전조치 등의 주요 현안이 다뤄졌다.

지난 27일 식약처가 공개한 중앙약사심의위원회 설치현황 및 활동내역서에 따르면 총 92명의 위원들이 약사제도분과위, 약전 및 의약품 등 규격분과위, 약효 및 의약품 등 안전대책분과위, 신약분과위, 생물의약품분과위 등 5개의 분과로 나눠 회의를 열었다.
60회의 출석 회의, 2회의 출석 회의 등 지난해 회의가 62번 열렸고, 식품의약품안전처 차장이 위원장을 맡아 수행했다.
가장 자주 열린 안건은 의약품 시판 후 조사(PMS) 계획(서) 변경의 타당성 심의였다. 주로 증례수 조정, 효능효과를 고려한 PMS 기간 연장 심의였다.
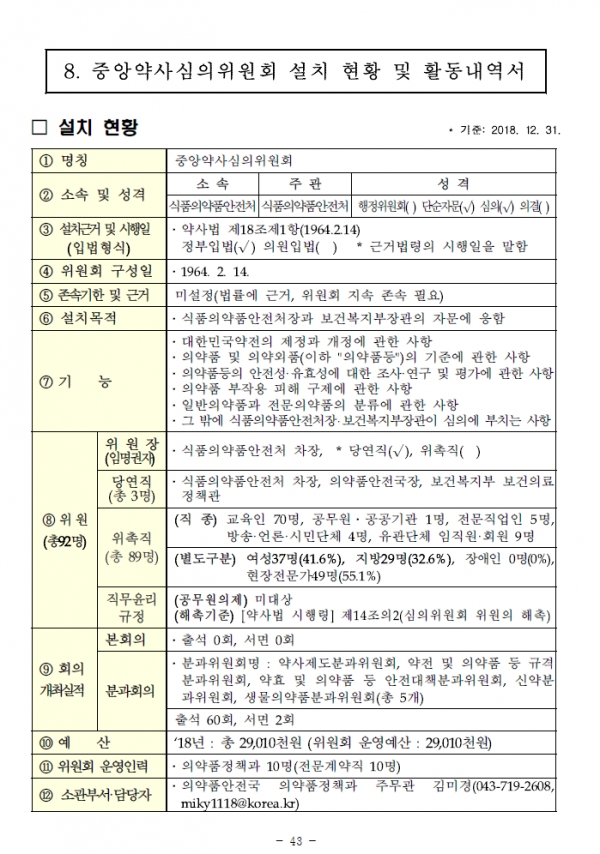
2018년 한 해동안 ▲릴피비린염산염 ▲메드록시프로게스테론아세테이트 ▲엑시티닙 ▲에리불린메실산염 등의 조사 계획 변경 타당성, ▲싸이트로핀에이카트리지주(소마트로핀) ▲릭수비스주 ▲심퍼니프리필드시린지주(골리무맙)의 증례수 조정, ▲엑시티닙 ▲산화질소 흡입제의 변경 타당성 여부(효능효과를 고려한 PMS 연장) ▲골리무맙 및 골리무맙의 시판 후 조사계획서 중 조사대상자 수 변경 타당성 안건이 논의됐다.
중앙약심은 SK케미칼의 바리다제가 임상 재평가 과정에서 대조군 선정과 층화기준, 피험자수 등 임상시험 계획의 재설정이 필요하다는 결과를 도출하기도 했다. 또, 탈니플루메이트 제제는 임상 재평가로 일부 효능·효과 등이 삭제됐다.
또한, 폐암 치료제 타그리소를 처방할 때 허가받은 동반진단 의료기기를 사용하도록 허가사항을 바꿨다.
중앙약심은 한 해동안 3건의 세포치료제 조건부허가 신청 타당성에 대해 '생명을 위협하는 질환 또는 중증의 비가역적 질환' 요건을 인정하지 않았다.
아울러 중앙약심은 "허가받은지 60여년이 다 된 퇴장방지의약품인 명인제약의 조현병치료제 네오마찐정에게 대체의약품이 있다면 생동성 평가를 면제하는 선례가 된다"며 "타 적응증으로 사용하기 때문에 생동성 평가를 실시해야 한다"고 결론을 내리기도 했다.
동아제약의 노스키나겔은 안전성·유효성 입증 방안에 있어 절차상 하자가 없다고 판단했다. 연고제를 겔제로 허가받으며 별도의 안전성·유효성 비교 시험이 없었다는 지적이 나왔지만 생체 외 방출시험을 진행하고, 연고제로 신규 허가받으며 동등성시험자료도 제출했다는 이유에서다.
이 밖에 중앙약심은 특정 제제의 재평가 결과 및 후속조치안 타당성, 임상시험계획 변경사항의 타당성, 2017년 집중모니터링 대상 의약품 분석 평가 결과 적정, 허가사항(허가조건) 변경 타당성, 의약품적정사용(DUR) 고시 개정 및 공고에 대한 타당성, 사르탄류 의약품 중 NDMA·NDEA 동시분석 시험법 타당성, NDMA 함유 발사르탄 의약품 복용환자 인체영향평가 등을 심의했다.
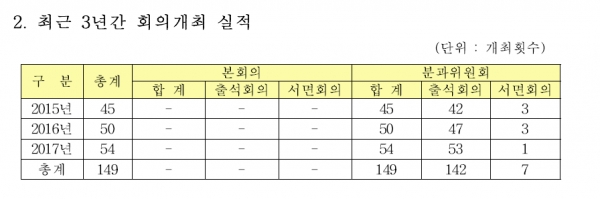
중앙약심은 최근 4년간 2015년 45건, 2016년 50건, 2017년 54건, 2018년 62건의 회의를 개최하며 해 마다 안건 심의를 늘리고 있다. 예산은 평균적으로 약 2900만원이 편성됐고, 약 4400만원의 예산이 집행되고 있다.

