단일·복합제 600여 품목 9월 특허만료 이후 출시 대기
식약처, NTTP 발생원인 파악...37ng/일 섭취허용량 기준 설정
오는 9월 특허만료로 시타글립틴 성분 후발약들이 대거 출시를 앞두고 있는 가운데, 식약당국이 불순물 관리를 당부하고 나섰다.
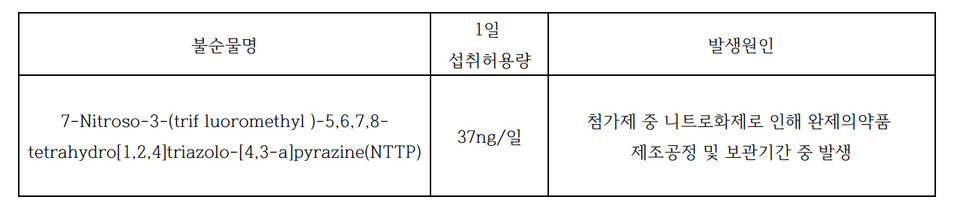
23일 업계에 따르면 식품의약품안전처는 시타글립틴 성분 함유 의약품에서 발생가능한 니트로사민류 불순물(7-Nitroso-3-(trif luoromethyl)-5,6,7,8-tetrahydro[1,2,4]triazolo-[4,3-a]pyrazine(NTTP))의 1일 섭취허용량을 '37ng/일'로 설정했다고 제약사들에 밝히고 안전조치를 지시했다.
또한 NTTP의 발생 원인은 첨가제 중 니트로화제로 인해 완제약 제조공정 및 보관기간 중 발생하는 것으로 파악했다.
이는 올해 초 시타글립틴 성분 오리지널 의약품인 자누비아에서 불순물이 검출돼 MSD가 자진회수를 진행한 것에 대한 후속조치로 풀이된다.
실제 MSD는 지난 3월 자누비아50mg의 일부 제품에서 불순물이 발견돼 식약처에 알리고 회수조치했다. 또한 회수조치한 제품 외 유통 중인 샘플에서는 문제가 없으며, 작년 7월 이후 NTTP 검사를 통과한 제품만 출하되고 있다고 밝혔다.
DPP-4억제제 계열 대표 품목인 자누비아는 단일제 원외처방조제액이 426억 원, 메트포르민을 결합한 복합제까지 총 1700억 원에 이른다. 이에 60여곳의 제약사에서 시타글립틴 성분 후발약 허가를 받았다. 단일제와 복합제 함량별로 따지만 허가된 품목 수만 600여개에 이른다.
9월 이후 우르르 쏟아질 시타글립틴 성분 후발약을 두고, 식약처는 제약사들에 불순물 관련 안전조치를 지시한 것이다.
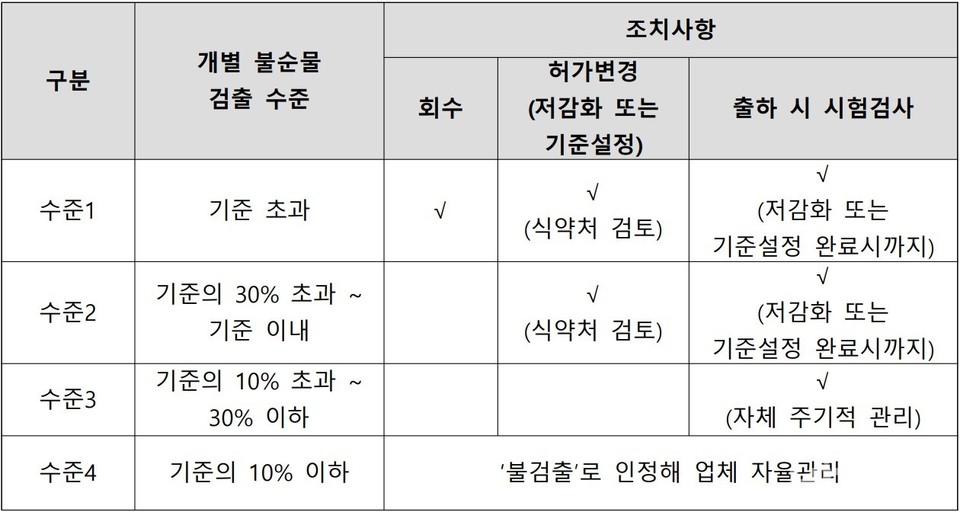
식약처는 불순물(NTTP) 시험·검사를 실시해 1일 섭취허용량(37ng/일) 이내 제품만 출하할 것을 당부했다. 시험결과 불순물이 검출되는 경우 검출 수준에 따른 단계별 조치를 취하라고도 했다.
안정성시험 관련, 사용기간 동안 NTTP 허용기준의 30% 이하로 관리될 수 있도록 안정성 시험을 실시하고, 기준을 초과하거나 초과가 우려되는 경우 식약처에 즉시 보고하라고 요청했다.