PPI+제산제 속 근육통 정조준 OTC 등장
임상선 티지페논 추격…만성기침 BLU-5937 국내 3상도
업계에서 가장 힘을 주는 1월답게, 첫 달의 두 번째 주 역시 여러 제품이 꾸준히 쏟아졌다. 1월 2주차에 허가받은 제품은 총 46건이었다. 물론 전 주 105건에 비해서는 적은 수이지만 출시 전월 27건에 비하면 80%가량 늘어난 수치다.
이번 주 가장 많이 등장했던 것은 아스트라제네카의 당뇨 치료제 포시가(성분 다파글리플로진)과 메트포르민 복합제 직듀오의 제네릭이다.
이들 제품은 오는 4월 7일 급여만료를 앞두고 급여신청을 하기 위해 제품을 빠르게 허가받으 것르 보인다. 지난 주와 마찬가지의 흐름이 2주차에도 이어진 셈이다. 이번 달에 제품을 허가받아 급여를 신청해야 2월 건강보험심사평가원 평가 및 3월 협상, 건정심 등을 거쳐 4월 특허 만료 후 출격이 가능하기 때문이다.
여기에 직듀오 제네릭 허가신청까지 이어지다 보니 두 제품의 제네릭 허가품목만 26품목에 달한다. 그야말로 절반 이상이 하나의 약을 향하고 있는 셈이다.
이런 가운데서도 시장에 등장한 프로톤펌프억제제(PPI)인 란소프라졸과 제산제인 침강탄산칼슘을 조합한 6개 품목도 눈에 띈다.
제네릭 중 한 품목이지만 흥미를 끄는 제품은 지엘파마의 지엘에스트라디올발레레이트정이다. 성분으로는 다소 어려운 이름이지만 갱년기 치료제인 바이엘의 프로기노바 그리고 치임제인 클레라와 동일 성분 제제다.
시장에서 경구용 제제는 바이엘과 현대약품의 인디비나 밖에 없던 상황이 3파전으로 치달은 것이다.
신약에서는 단연 화이자의 필라델피아 염색체 양성 만성 골수성백혈병 치료제인 보술리프의 등장이 눈길을 끈다. 만성골수성백혈병은 대부분 필라델피아 염색체에 의해 발생하는 데 보술리프는 백혈병을 유발하는 비정상적인 혈액세포 과도증식을 막는다.
더욱이 지난 2012년 승인 이후 햇수로만 11년만에 도입되는 제품인만큼 백혈병을 앓는 이에게도 또다른 기회가 될 수 있는 상황이다.
상대적으로 특징이 적은 일반의약품 분야에서도 눈에 띄는 제품은 있었다. 광동제약의 머스레놀정(아세트아미노펜/산화마그네슘)이다. 국내에서는 생소한 조합이지만 실제 편두통이나 근육 통 등에는 진통제와 함께 마그네슘을 함깨 먹도록 하는 경우가 있다. 마그네슘이 가진 근육경련이나 말초혈행장애에 도움이 되기 때문이다.
그 전까지는 아이월드제약이 두 성분에 카페인을 넣은 제품을 허가받은 적 있었지만 이번 제품은 이름부터 근육통을 겨냥한 제품이라는 데서 흥미롭게 볼 만하다. 현행 표준제조기준 이내의 새 조합을 찾는 것으로 보인다.
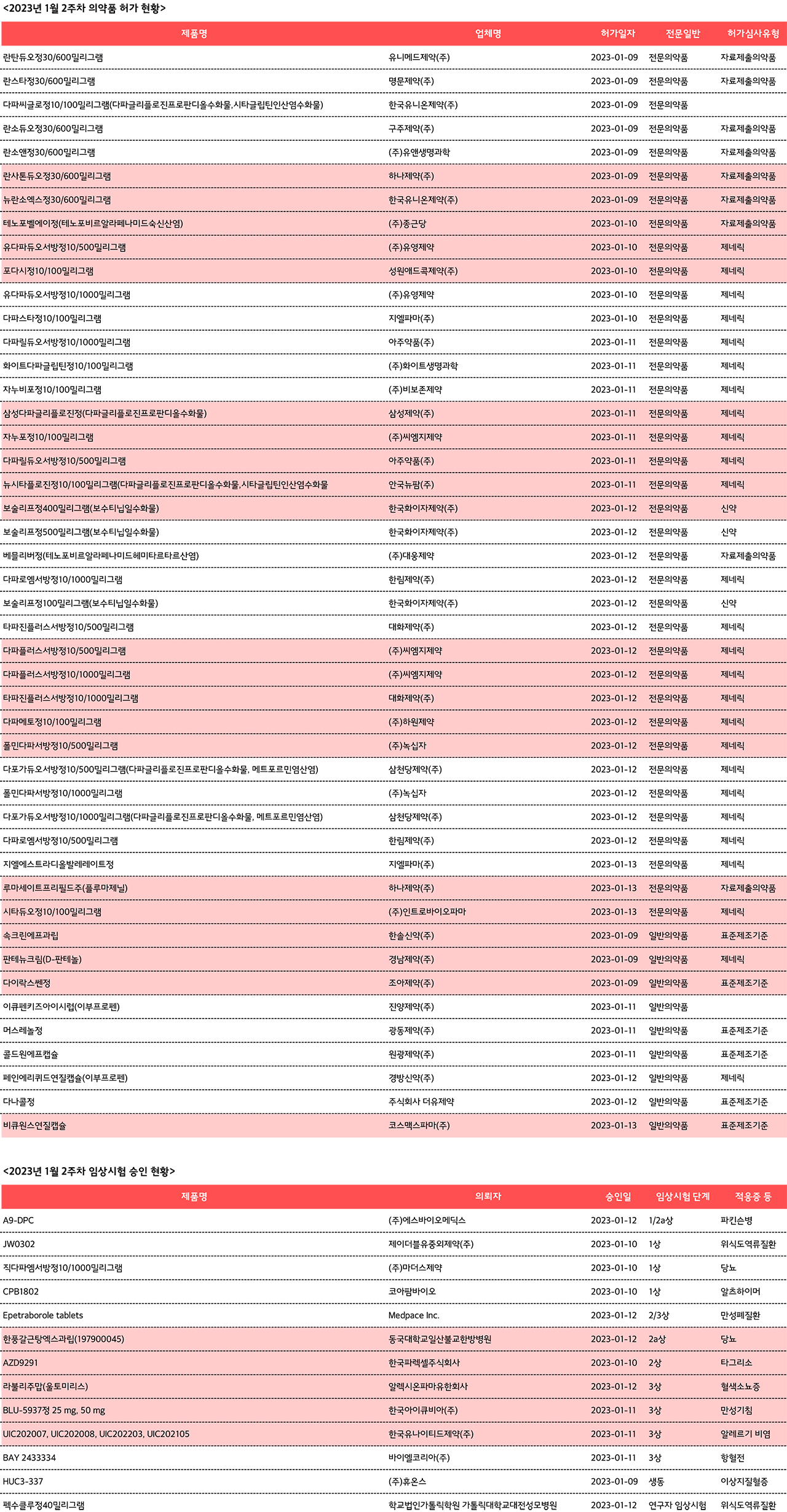
같은 기간 임상은 14건으로 상대적으로 많지는 않은 모습이었다. 다만 생각보다 굵직한 관심을 끌 수 있는 제품의 임상이 몇 건 눈에 띈다.
CRO가 진행하는 임상 중에는 한국아이큐비아의 BLU-5937가 흥미롭다. 해당 제품은 캐나다 벨루스헬스가 개발한 P2X3 수용체 길항제 계열의 난치성 만성기침 치료제다. 회사가 발표한 2b상 톱라인 데이터를 보면 난치성 만성기침 환자 310명 대상 평가에서 해당약물 투여군의 24시간 기침 빈도는 위약군 대비 34% 감소한 것으로 나타났다.
최근 바이엘의 엘리아픽산트 연구 중단과 머크의 게파픽산트 미국 허가 불승인 등의 이슈가 이어졌던 가운데 이들 제품의 효과성이 입증될 경우 세계 진입 이후 국내 시장에도 진입할 수 있을 지 여부에 관심이 모아진다.
폐암 치료제의 에이스 중 하나인 타그리소의 새로운 임상은 한국파렉셀에서 진행한다. 이번 임상은 완전 종양 절제술 후 보조 화학요법을 받거나 받지 않은 표피 성장 인자 수용체 변이 양성 Stage II-IIIB 비소세포 폐암 시험대상자의 5년 장기 효과를 입증하는 내용을 담고 있다.
이 밖에 메드플레이스에서 진행하는 만성폐질환 치료제 에페트라보롤의 치료 불응성 미코박테륨 아비움 복합체 치료 2/3상도 관심을 끈다.
제약사에서 진행하는 제품 중에는 한국유나이티드제약의 UIC202007 및 UIC202008의 3상이 눈에 듼다. 해당 제품은 천식과 다년성 알레르기 비염 치료제다.
알렉시온파마는 발작성 야간 혈색소뇨증 치료제 '울토미리스'의 신손상 및 신장사건 예방 관련 3상을 승인 받았다.
코아팜바이오의 알츠하이머 치료제의 제형변경 제품 CPB1802와, 에스바이오메딕스의 파킨슨병 치료제인 A9-DPC도 각각 1상과 1/2a상을 승인받으면서 제품화를 위한 한 걸음을 디뎠다.
후발 제제 개발을 위한 생동성시험은 1건이었다. 휴온스는 지난 1월 9일 자사의 HUC3-337 개발을 위한 시험을 승인받았다. 해당 제품이 시험을 무사히 마쳐 출시될 경우 대표격인 대원제약의 티지페논(페노피브레이트콜린)의 첫 후발 제제라는 이름을 얻는다.
고중성지방혈증 치료제인 티지페논은 지난해 출시 5년만에 누적매출 400억 원을 기록하며 시장에서 자리를 잡았다. 여기에 상대적으로 높은 약가와 아직은 없는 경쟁자 등이 회사의 구미를 당긴 것으로 보인다. 더욱이 현재까지 식품의약품안전처 목록에 등재된 특허도 없다.

